Atezolizumab的作用機理及在抗腫瘤研究中的應用實例分享_abio生物試劑品牌網
一、 Atezolizumab 的作用機理
在正常生理狀態下,PD-L1/PD-1信號通路對維持機體免疫穩態至關重要。PD-L1主要表達于抗原呈遞細胞(如樹突狀細胞、巨噬細胞等)以及部分組織細胞表面,而PD-1則表達于活化的 T 細胞、B細胞和自然殺傷細胞表面。當 PD-L1與PD-1 結合時,可向T細胞傳遞抑制性信號,抑制T細胞的活化、增殖以及細胞因子的分泌,從而避免過度免疫反應對機體正常組織造成損傷。在腫瘤微環境中,腫瘤細胞常常高表達 PD-L1。腫瘤細胞表面的 PD-L1 與浸潤到腫瘤組織中的T細胞表面的PD-1結合,激活T細胞內的抑制性信號轉導途徑,使T細胞功能受到抑制,無法有效識別和殺傷腫瘤細胞,導致腫瘤細胞逃避免疫監視,得以持續生長和轉移。這種腫瘤免疫逃逸機制在多種癌癥的發生、發展過程中發揮著關鍵作用 [1]。Atezolizumab 能與鼠類PD-L1反應(適用于人源及非人源化小鼠)。
Atezolizumab (Anti-PD-L1,AbMole,M6101)是一種人源化IgG1單克隆抗體,其Fc區存在N298A突變,該突變能夠抑制Atezolizumab與NK細胞膜上的CD16分子的結合,因此能避免對T細胞產生抗體依賴性細胞介導的細胞毒性(ADCC)效應。Atezolizumab能以高親和力的形式結合PD-L1(解離常數Kd≈0.4 nM),阻斷PD-L1/PD-1及PD-L1/B7-1信號軸。Atezolizumab對PD-1/PD-L1信號通路的阻斷可恢復T細胞增殖、細胞因子釋放及細胞毒性功能 [2]。
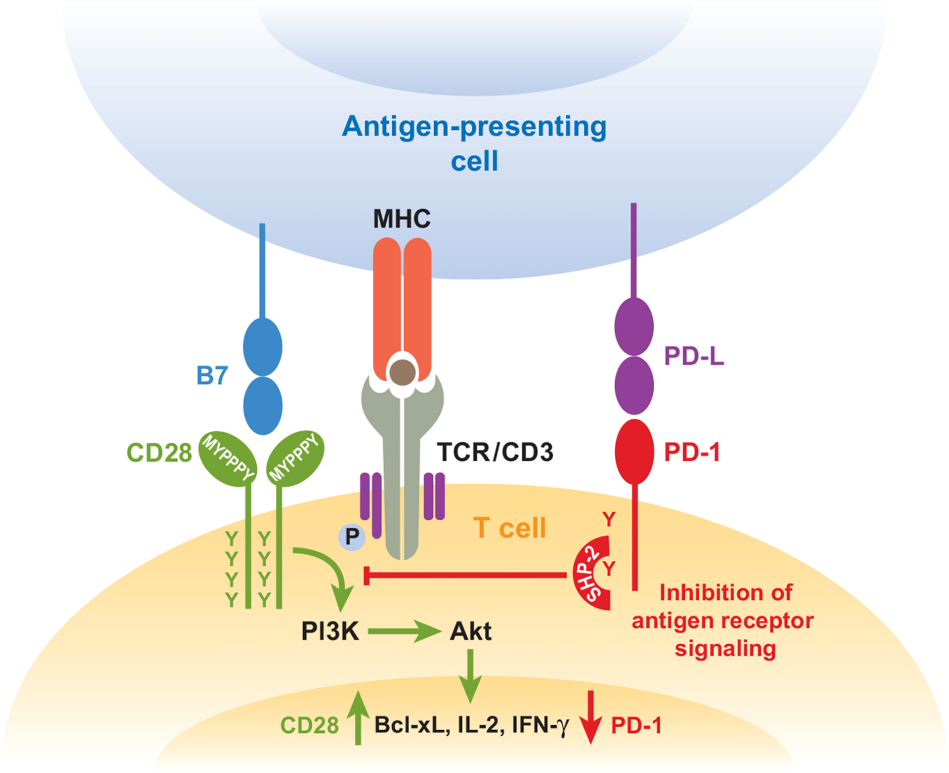
 圖 1. 免疫檢查點與腫瘤細胞的免疫逃逸示意圖
[1]
圖 1. 免疫檢查點與腫瘤細胞的免疫逃逸示意圖
[1]
二、 Atezolizumab 的科研應用
Atezolizumab (Anti-PD-L1,AbMole,M6101)作為研究工具,能有效調節不同實體瘤中的免疫微環境。Atezolizumab通過激活T細胞的殺傷能力,以及聯合多種抑制劑和人源化單抗,有效抑制了多種腫瘤動物模型。在肝細胞癌(HCC)的研究中,Atezolizumab可以聯合VEGF通路拮抗劑如Bevacizumab ,VEGF通路抑制可減少調節性T細胞(Treg)浸潤及髓源性抑制細胞(MDSC)活性,同時促進T細胞浸潤;Atezolizumab則解除T細胞功能抑制,二者聯合顯著重塑了腫瘤免疫微環境(TIME),增強抗腫瘤免疫 [3]。在HER2陽性的胃癌研究中,Atezolizumab與Trastuzumab(Anti- HER2) 聯用,有效抑制腫瘤的生長和轉移 [4]。在一項對非小細胞肺癌細胞A-549的異種移植小鼠(BALB/c-Nude)模型的研究中,通過靜脈注射Atezolizumab,結果顯示腫瘤體積明顯縮小,且小鼠血清IL-4、INF-γ濃度均有不同程度升高,證實Atezolizumab對小鼠免疫系統的抗腫瘤調節 [5]。Atezolizumab還能用于多種動物的腫瘤模型,包括前列腺癌 [6]、膀胱癌 [7]、三陰性乳腺癌等 [8]。是腫瘤免疫研究領域中強大的工具。 2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
三、 范例詳解
1. Acta Pharmaceutica Sinica B 13(2) (2023) 632-64
中山大學附屬第一醫院、廣州中醫藥大學的科研團隊在上述文章中探討了冷凍消融(CRA)和微波消融(MWA)兩種技術與PD-L1抗體在肝癌(HCC)中的聯合抑制效果。結果顯示,CRA 比 MWA 更適合與抗 PD-L1 抗體聯合應用,因其能誘導更多的T細胞浸潤,且減少 PD-L1高表達CD11b陽性髓系細胞浸潤。在實驗設計中科研人員使用了來自AbMole的兩種抗PD-L1人源化單抗,分別是具有ADCC效應的Avelumab(AbMole,M3813),和不具備ADCC效應的 Atezolizumab (Anti-PD-L1,AbMole,M6101)處理H22肝癌細胞同種移植瘤BALB/c小鼠。
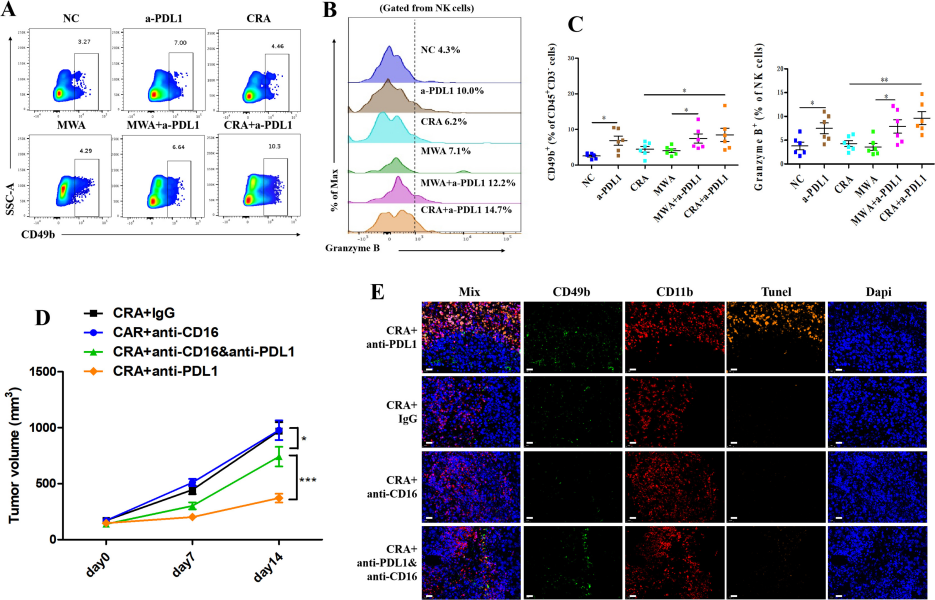
 圖 2. Bavencio induces more PD-L1highCD11b myeloid cells killing than Tecentriq via ADCC effect
[9]
圖 2. Bavencio induces more PD-L1highCD11b myeloid cells killing than Tecentriq via ADCC effect
[9]
2. J Control Release. 2022 Nov;351:255-271.
中國海洋大學的科研人員在上述文章中設計了一種癌細胞膜偽裝的明膠納米制劑(CSG@B16F10),用于共遞送產氧劑過氧化氫酶(CAT)和 CD73siRNA,以改善腫瘤缺氧微環境并沉默 CD73,從而增強免疫檢查點阻斷療法的效果。該納米顆粒借助癌細胞膜的特性可實現免疫逃逸和同源靶向,在腫瘤微環境中通過基質金屬蛋白酶(MMP)響應釋放負載物。其中,釋放出的CAT可通過分解腫瘤內過量過氧化氫產生內源性氧氣以緩解缺氧,CD73 siRNA則通過基因沉默抑制CD73表達,二者協同阻斷CD73-腺苷通路,減少T細胞免疫抑制。在B16F10黑色素瘤移植小鼠(C57BL/6)模型中,CSG@B16F10與PD-L1抗體聯合使用時,可顯著增強細胞毒性T細胞(CTL)浸潤、減少調節性T細胞(Tregs),并提高抗腫瘤細胞因子分泌。在實驗設計中,研究團隊使用了由AbMole提供的 Atezolizumab (Anti-PD-L1,AbMole,M6101),用于阻斷 PD-1/PD-L1 軸,解除腫瘤細胞對T細胞的免疫抑制,恢復T細胞對癌細胞的識別和殺傷能力。并且在研究中發現Atezolizumab與CSG@B16F10之間表現出協同作用 [10]。
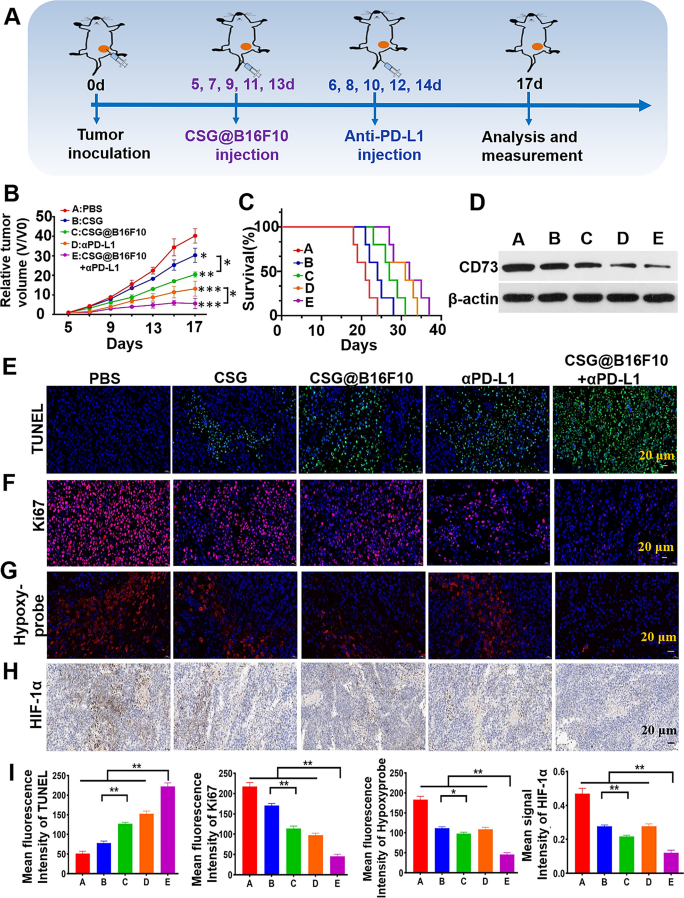
 圖 3. The antitumor study of CSG@B16F10 + αPD-L1 in vivo
[10]
圖 3. The antitumor study of CSG@B16F10 + αPD-L1 in vivo
[10]
3. Cancer Res. 2021 Oct 1;81(19):5074-5088.
中南大學湘雅醫學院、湖南省腫瘤醫院的科研團隊在本文章中探討了 EB 病毒(EBV)編碼的環狀 RNA circBART2.2,以及它在鼻咽癌(NPC)免疫逃逸中的作用及機制。研究發現,circBART2.2在NPC細胞中高表達,通過與 RIG-I 蛋白的解旋酶結構域結合,激活下游轉錄因子 IRF3 和 NF-κB,進而上調 PD-L1 的表達。PD-L1 的高表達會抑制 T 細胞功能(如減少 IFN-γ 分泌、促進 T 細胞凋亡),最終導致 NPC 的免疫逃逸。體內外實驗均證明了這一機制。AbMole提供的Atezolizumab作為抗 PD-L1 抗體,在實驗中用于阻斷 PD-L1 的功能,以驗證 circBART2.2 是否通過PD-L1介導T細胞抑制。具體而言,當加入 Atezolizumab 后,circBART2.2過表達所誘導的 T 細胞凋亡被顯著抑制,T 細胞的 IFN-γ 分泌能力得以恢復,證實了 circBART2.2 對 T 細胞功能的抑制依賴于 PD-L1,而 Atezolizumab 可通過阻斷 PD-L1 逆轉這種免疫抑制效應 [11]。在上述研究中,動物模型為鼻咽癌細胞HONE1異種移植瘤雌性裸鼠,實驗人員多次使用了來自AbMole的 Atezolizumab (Anti-PD-L1,AbMole,M6101)。
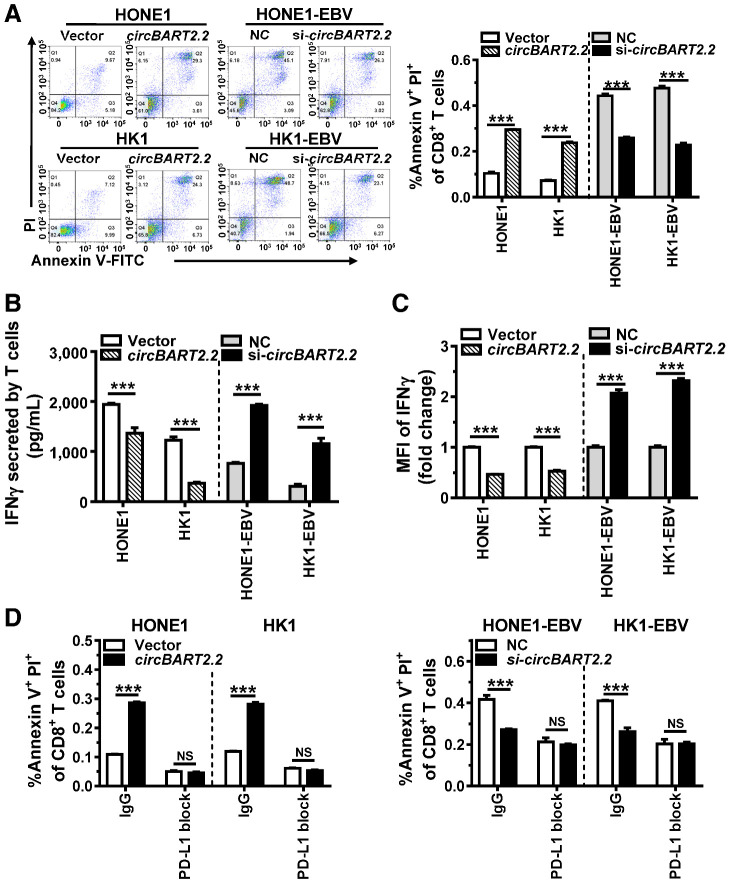
 圖 4. circBART2.2 promoted T-cell apoptosis and inhibited IFNγ secretion of T cells through PD-L1
[11]
圖 4. circBART2.2 promoted T-cell apoptosis and inhibited IFNγ secretion of T cells through PD-L1
[11]
AbMole是ChemBridge中國區官方指定合作伙伴。


參考文獻及鳴謝
[1] M. E. Keir, M. J. Butte, G. J. Freeman, et al., PD-1 and its ligands in tolerance and immunity, Annual review of immunology 26 (2008) 677-704.
[2] E. Cha, J. Wallin, M. Kowanetz, PD-L1 inhibition with MPDL3280A for solid tumors, Seminars in oncology 42(3) (2015) 484-7.
[3] Jinyeong Lim, Myung Ji Goh, Byeong Geun Song, et al., Unraveling the immune-activated tumor microenvironment correlated with clinical response to atezolizumab plus bevacizumab in advanced HCC, JHEP Reports 7(4) (2025) 101304.
[4] M. Bonomi, D. Spada, G. L. BAIocchi, et al., Targeting HER2 in Gastroesophageal Adenocarcinoma: Molecular Features and Updates in Clinical Practice, International journal of molecular Sciences 25(7) (2024).
[5] Meliha Ekinci, Ralph Santos-Oliveira, Derya Ilem-Ozdemir, Biodistribution of 99mTc-PLA/PVA/Atezolizumab nanoparticles for non-small cell lung cancer diagnosis, European Journal of Pharmaceutics and Biopharmaceutics 176 (2022) 21-31.
[6] C. E. Wee, B. A. Costello, J. J. Orme, et al., Chemotherapy with atezolizumab for small cell or neuroendocrine carcinoma of the prostate: A single institution experience, The Prostate 81(13) (2021) 938-943.
[7] First-Line Atezolizumab Effective in Bladder Cancer, Cancer discovery 6(8) (2016) Of7.
[8] A. V. F. Massicano, P. N. Song, A. Mansur, et al., [(89)Zr]-Atezolizumab-PET Imaging Reveals Longitudinal Alterations in PDL1 during Therapy in TNBC Preclinical Models, Cancers 15(10) (2023).
[9] Jizhou Tan, Ting Liu, Wenzhe Fan, et al., Anti-PD-L1 antibody enhances curative effect of cryoablation via antibody-dependent cell-mediated cytotoxicity mediating PD-L1highCD11b+ cells elimination in hepatocellular carcinoma, Acta Pharmaceutica Sinica B 13(2) (2023) 632-647.
[10] Cong-Shan Yuan, Zhuang Teng, Shuang Yang, et al., ReshaPIng hypoxia and silencing CD73 via biomimetic gelatin nanotherapeutics to boost immunotherapy, Journal of Controlled Release 351 (2022) 255-271.
[11] J. Ge, J. Wang, F. Xiong, et al., Epstein-Barr Virus-Encoded Circular RNA CircBART2.2 Promotes Immune Escape of Nasopharyngeal Carcinoma by Regulating PD-L1, Cancer research 81(19) (2021) 5074-5088.
本站“ABIO生物試劑品牌網”圖片文字來自互聯網
如果有侵權請聯系微信: nanhu9181 處理,感謝~


