RSL3鐵死亡激動劑誘導機制及其在抗腫瘤研究中的應用_abio生物試劑品牌網
在細胞程序性死亡的研究領域中,鐵死亡作為一種獨特的細胞死亡方式,多年來受到持續關注。RSL3(AbMole,M9060)是目前廣泛應用的鐵死亡激動劑,RSL3通過共價抑制谷胱甘肽過氧化物酶4(GPX4)的活性,阻斷脂質過氧化物的還原過程,進而觸發細胞鐵死亡。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等科研試劑,全球大量文獻專利引用。
一、RSL3 誘導鐵死亡的機制
1. 對谷胱甘肽過氧化物酶 4(GPX4)的抑制作用
GPX4是細胞內抵抗脂質過氧化、維持氧化還原平衡的關鍵酶。RSL3(AbMole,M9060)的核心作用機制之一是直接結合并抑制GPX4的活性。當RSL3與GPX4相互作用后,GPX4的催化活性中心被破壞,導致其無法有效地將脂質過氧化物還原為相應的醇,使得細胞內脂質過氧化物大量積累。這種積累打破了細胞內氧化與抗氧化的平衡,引發一系列級聯反應,最終導致細胞走向鐵死亡[1]。例如,在多種細胞系的研究中發現,RSL3處理后,細胞內GPX4蛋白的活性顯著降低,同時脂質過氧化產物如丙二醛(MDA)等水平明顯升高[2]。
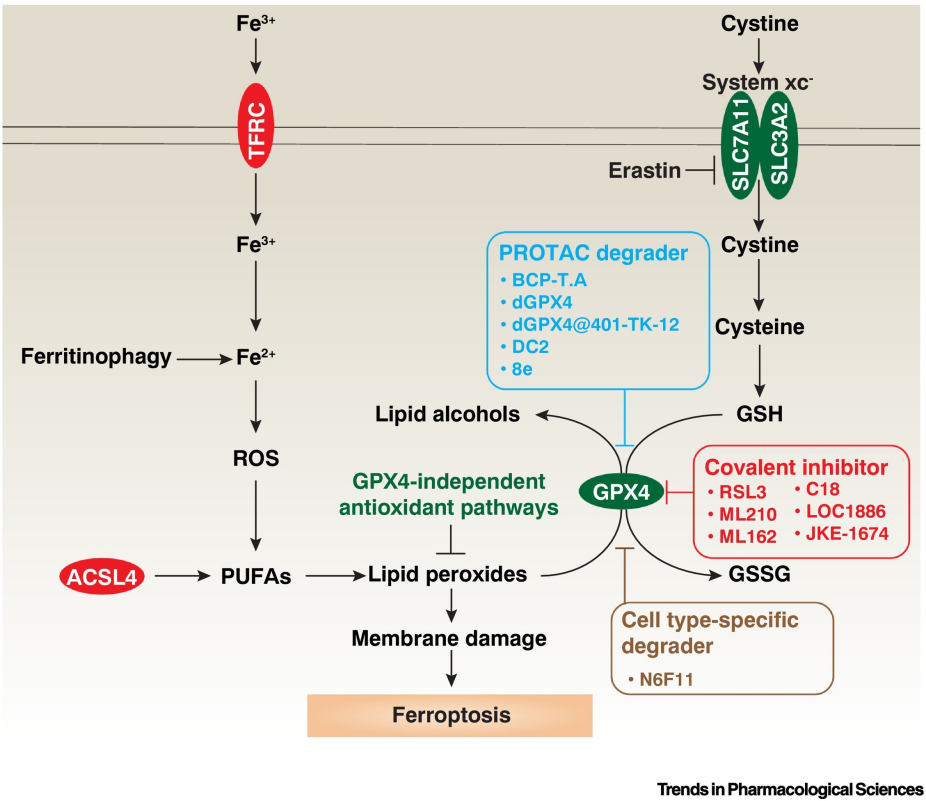
圖 1. The core mechanism of ferroptosis[1]
2. 與其他信號通路的關聯
除了直接作用于 GPX4以及影響鐵代謝和脂質過氧化外,RSL3(AbMole,M9060)誘導鐵死亡的過程還會涉及其他多個信號通路。例如,有研究表明 RSL3處理細胞后,會引起Nrf2(核因子E2相關因子 2)信號通路的改變。正常情況下,Nrf2與Keap1(Kelch 樣 ECH 相關蛋白1)結合存在于細胞質中,當細胞受到氧化應激等刺激時,Nrf2與Keap1解離并進入細胞核,啟動一系列抗氧化基因的轉錄表達,以增強細胞的抗氧化防御能力。然而,RSL3處理后,可引起Nrf2的泛素化降解,使得細胞內抗氧化基因的表達減少,從而削弱了細胞對氧化應激的抵抗能力,促進鐵死亡的發生[3]。
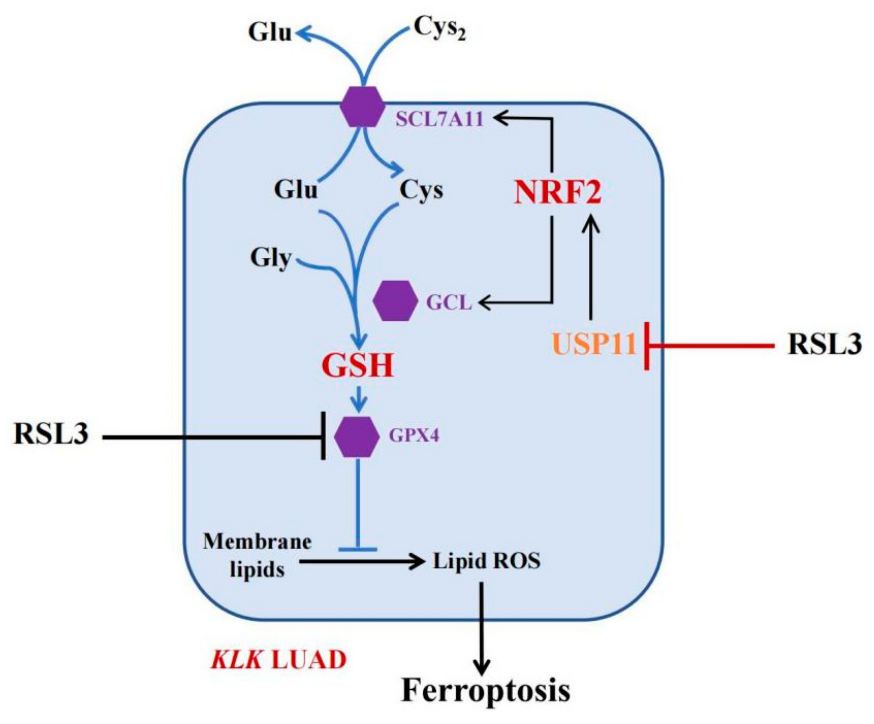
圖 2. RSL3通過抑制 USP11 活性,進而誘導NRF2蛋白的泛素化和降解[3]
二、RSL3在科研中的應用
1. RSL3可誘導多種細胞系的鐵死亡
RSL3(AbMole,M9060)能夠誘導多種細胞系的鐵死亡。例如,在攜帶RAS突變基因的HT-1080纖維肉瘤細胞模型中,RSL3通過直接抑制谷胱甘肽過氧化物酶4(GPX4)的活性,導致細胞內活性氧(ROS)水平上升和脂質過氧化,從而誘導鐵死亡[4]。此外,在肺腺癌(LUAD)細胞系中,RSL3以劑量依賴性方式誘導A549、H2122、H23和H1299細胞死亡,且這種死亡可以通過鐵死亡抑制劑去鐵胺(DFO)部分挽救[5]。在神經母細胞瘤N2A細胞中,RSL3誘導ROS水平上升和細胞鐵死亡,降低了細胞的存活率。這些研究表明RSL3在多種細胞系中均能誘導鐵死亡[6]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
2. RSL3誘導細胞鐵死亡的形態學及生化指標的變化
RSL3(AbMole,M9060)誘導細胞發生鐵死亡時,細胞會出現一系列獨特的形態學和生化指標變化,有多種方法可對其進行檢測。首先是細胞活力的降低,一般采用CCK-8(AbMole,M4839)或ATP細胞活力檢測試劑盒(AbMole,M55403)等進行檢測。在形態學上,細胞鐵死亡表現為體積縮小,線粒體體積變小、膜密度增加,外膜破裂等,這些變化可以使用生物電鏡技術進行觀測。而在生化指標方面,最顯著的變化是谷胱甘肽(GSH)耗竭和脂質過氧化產物的大量積累。可以采用GSH探針和脂質過氧化探針進行顯微成像分析,如GSHtracer(AbMole,M25392)、ABDP 581/591 C11(AbMole,M29325)。此外,細胞內鐵離子濃度也會升高,可通過檢測細胞內總鐵離子含量或使用鐵離子特異性熒光探針FeRhoNox-1(AbMole,M21552)來觀察鐵離子的濃度和分布變化。
3. 在動物模型中對腫瘤生長的影響
在腫瘤動物模型中,RSL3(AbMole,M9060)展現出抑制腫瘤生長的潛力。對BJeLR細胞異種移植的無胸腺裸鼠給予RSL3處理后,其腫瘤生長受到顯著抑制,腫瘤體積明顯減小[7]。這表明RSL3 在體內環境中同樣能夠誘導腫瘤細胞發生鐵死亡,從而抑制腫瘤的生長和發展。進一步對腫瘤組織進行分析發現,與對照組相比,RSL3處理組腫瘤組織中GPX4活性降低,脂質過氧化產物增多,并且觀察到腫瘤細胞出現典型的鐵死亡形態學特征[7]。
三、范例詳解
廈門大學的研究團在上述文章中發現H2S使非小細胞肺癌(NSCLC)細胞對鐵死亡更加敏感,特別是當半胱氨酸水平較低時。H2S聯合胱氨酸耗竭可顯著提高以鐵死亡為基礎的腫瘤抑制效率。從機制上講,H2S使S-腺苷型同型半胱氨酸水解酶(SAHH)上的第195個半胱氨酸過硫,因此可降低其酶活性。這導致半胱氨酸水平下降,和鐵死亡負調因子GSH水平的降低。上述這些變化最終增加了NSCLC細胞對鐵死亡的敏感性。在實驗中,科研人員使用了由AbMole提供的鐵死亡激動劑RSL3(AbMole,M9060)和鐵死亡抑制劑Deferoxamine(DFO,AbMole,M5129)處理NSCLC細胞(H1299,A549等),以闡明H2S在鐵死亡過程中的作用[8]。
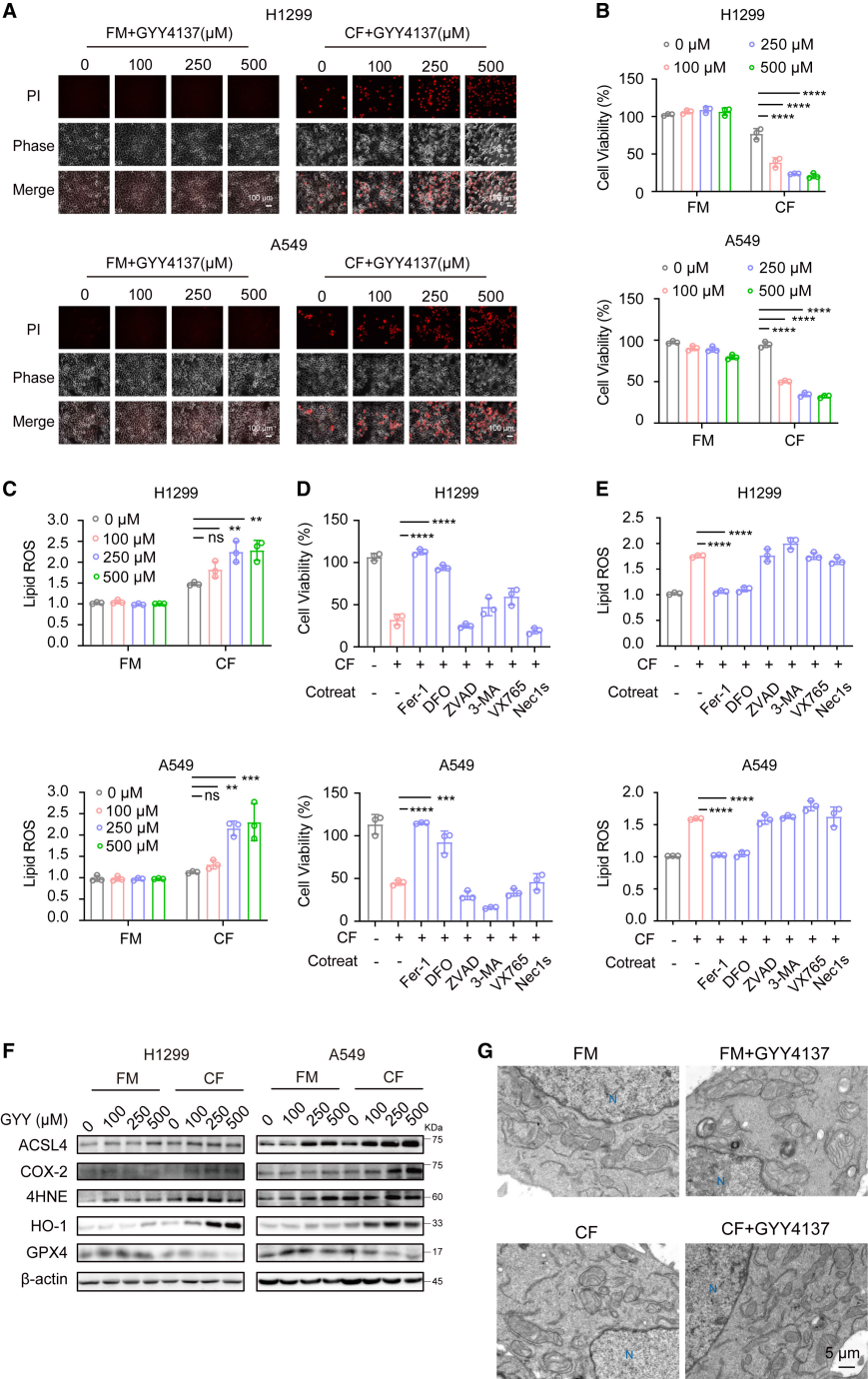
圖 3. SAHH acts as a target of H2S during H2S-promoted ferroptosis[8]

參考文獻及鳴謝
[1] Jiao Liu, Daolin Tang, Rui Kang, Targeting GPX4 in ferroptosis and cancer: chemical strategies and challenges, Trends in pharmacological Sciences 45(8) (2024) 666-670.
[2] Pao Jen Kuo, Cheng Shyuan Rau, Yi Chan Wu, et al., Translational Potential of BAIcalein in Mitigating RSL3-Induced Ferroptosis in Fibroblasts: Implications for Therapeutic Interventions, 21(7) (2024).
[3] W. Zhang, X. Li, J. Xu, et al., The RSL3 Induction of KLK Lung Adenocarcinoma Cell Ferroptosis by Inhibition of USP11 Activity and the NRF2-GSH Axis, Cancers 14(21) (2022).
[4] L. Pedrera, L. Prieto Clemente, A. Dahlhaus, et al., Ferroptosis triggers mitochondrial fragmentation via Drp1 activation, Cell death & disease 16(1) (2025) 40.
[5] R. Srinivasan, H. S. Han, P. Subramanian, et al., LiPId ROS- and Iron-Dependent Ferroptotic Cell Death in Unicellular Algae Chlamydomonas reinhardtii, Cells 12(4) (2023).
[6] R. Lu, Y. Jiang, X. Lai, et al., A Shortage of FTH Induces ROS and Sensitizes RAS-Proficient Neuroblastoma N2A Cells to Ferroptosis, International journal of molecular sciences 22(16) (2021).
[7] S. Li, Y. He, K. Chen, et al., RSL3 Drives Ferroptosis through NF-κB Pathway Activation and GPX4 Depletion in Glioblastoma, Oxidative medicine and cellular longevity 2021 (2021) 2915019.
[8] Hualei Zheng, Huidi Chen, Yunjie Cai, et al., Hydrogen sulfide-mediated persulfidation regulates homocysteine metabolism and enhances ferroptosis in non-small cell lung cancer, Molecular cell 84(20) (2024) 4016-4030.e6.
本站“ABIO生物試劑品牌網”圖片文字來自互聯網
如果有侵權請聯系微信: nanhu9181 處理,感謝~





