納米顆粒的設計、作用機制、體內外療效及免疫調控_abio生物試劑品牌網
本期,我們將從納米顆粒設計、作用機制、體內外療效及免疫調控等維度展開深度解讀,揭示該研究如何通過跨學科創新為侵襲性腫瘤治療帶來新希望!
Section.01
超聲觸發型納米顆粒 (RC NPs)
近期,中國科學家開發的 超聲觸發型納米顆粒 (RC NPs) 于 Advanced Materials 亮相[1]。在文章課題組的操作下,RC NPs 仿佛植入癌細胞的“木馬病毒”,只等一“聲”令下,就將癌細胞各個擊破。
RC NPs 由可降解的聲敏聚合物 (Poly RA) 和可負載金屬離子的多酚結構聚合物 (Poly MPN) 自組裝而成。
Tips:
- 聲敏外殼 (Poly RA): 即含釕配合物 (Ruthenium Complexes, RBB) 聲敏劑 (Em=534 nm)。超聲照射下,RBB 可產生活性氧 (ROS),如 “納米爆破手”一樣破壞癌細胞膜。
- 銅離子彈匣 (Poly MPN): 這是一種帶有硫縮酮鍵“保險”的金屬-多酚網絡結構,具有 ROS 敏感性和金屬結合親和力,能有效鎖定 Cu2?。超聲和 ROS 導致硫縮酮鍵斷裂而釋放銅離子,損傷線粒體功能、誘導銅死亡。
RC NPs 可通過產生 ROS 和誘導銅死亡來殺死癌細胞。其搭載 聲動力療法 (SDT) 平臺,以獨特的優勢:如更深的組織穿透力、卓越的組織選擇性、更高的安全性,具有廣闊適用前景。RC NPs 更針對 “癌中之王” 胰腺癌,在多種動物模型中都展現出驚人療效[1]。
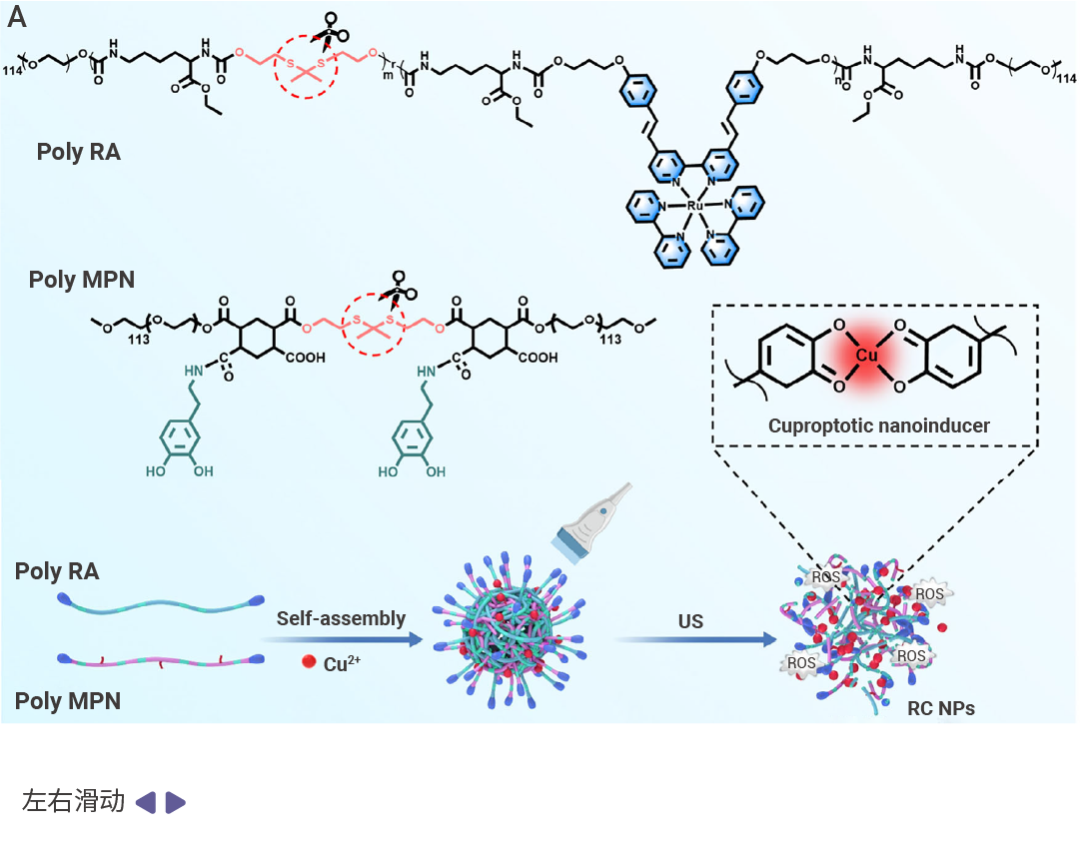
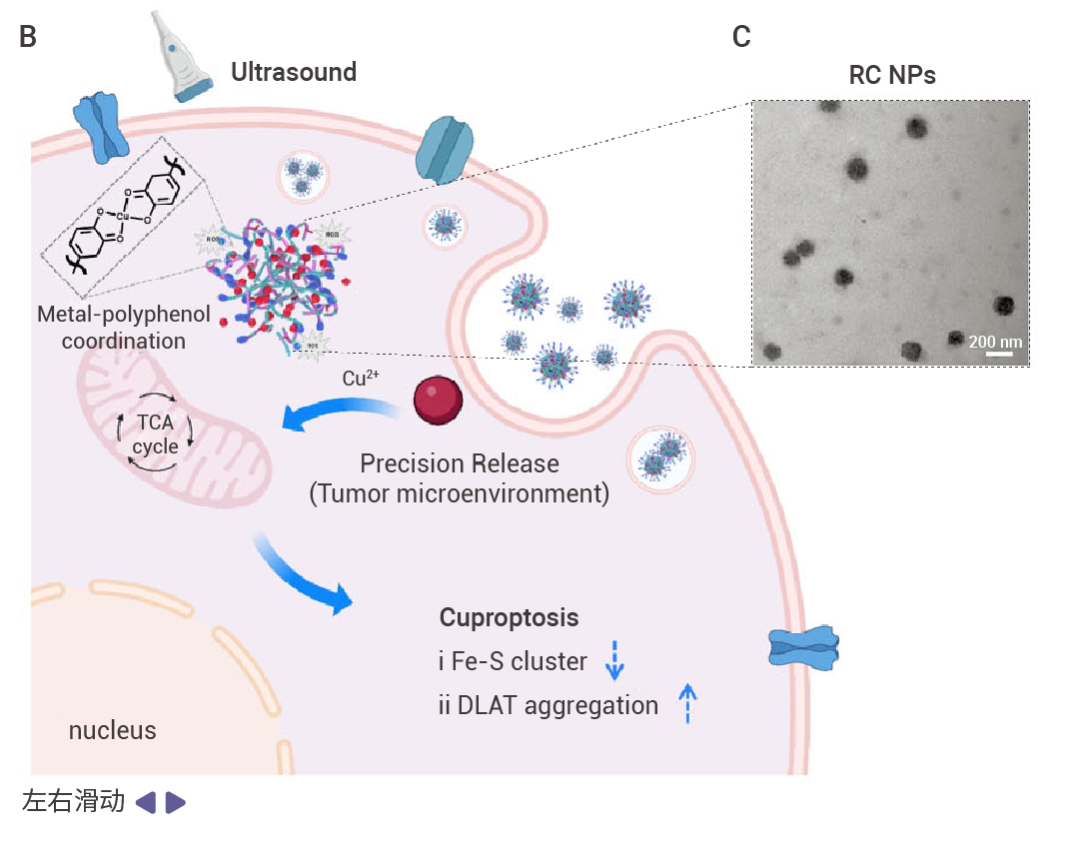
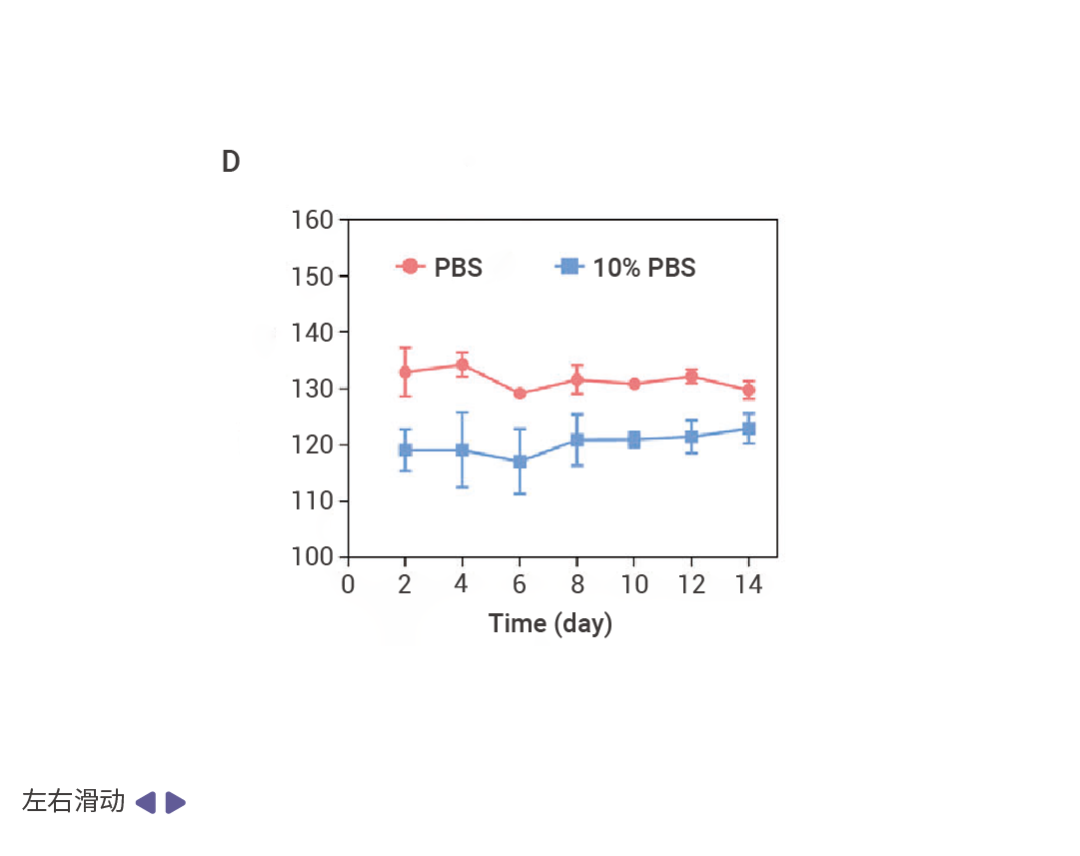
圖 1. RC NPs 是由兩親性聚合物 Poly RA 和 Poly MPN 自組裝的可生物降解的納米載體 [1] 。
A:RC NPs 組成示意圖。Poly RA 是可生物降解聚合物,含有 RBB 分子和硫縮酮鍵。一方面,這種結構賦予 Poly RA 在聲動力條件下產生 ROS (活性氧) 的特性。另一方面,ROS 的產生會破壞硫縮酮鍵,導致 Poly MPN 降解。而 Poly MPN 是用類似方法合成的具有 ROS 敏感特性且能夠與金屬結合的兩親性聚合物。B-D:RC NPs 的外觀及穩定性。RC NP 進入細胞促進銅死亡,經 TEM 成像分析為均勻分布的球形結構 (B,C)。在含有或不含 10% 胎牛血清 (FBS) 的 PBS 中,RC NP 的粒徑在 14 天內均未發生明顯變化,具有可觀的穩定性 (D)。
想象一下,一群微型納米機器人在體內游走。遇到腫瘤后,只需外界一聲‘超聲指令’,就能瞬間釋放銅離子和活性氧,精準爆破癌細胞。
Section.02
RC NPs 對癌細胞的雙重絕殺
超聲波照射下,RC NPs 可快速降解 (~5 min) ,在腫瘤局部釋放 Cu 2+ 和 ROS (使用 DPBF 作為 1O2 的特異性探針,超聲處理 2.5 min 后,~83% DPBF 已被氧化降解) 。隨著脂酰化蛋白聚集和鐵硫簇蛋白耗竭,RC NPs 進一步引起線粒體損傷與代謝通路瓦解,最后激活銅死亡 [1] 。
RC NPs 還同步觸發 免疫原性細胞死亡 (ICD),激活系統性抗癌免疫反應,包括損傷相關分子模式 (DAMPs) 的釋放與免疫細胞的活化。進一步,RC NPs 激活系統性 T 細胞免疫與免疫抑制微環境重塑,增強效應 T 細胞 (CD8? T 細胞) 浸潤,活化自然殺傷細胞,并抑制調節性 T 細胞 (Treg)[1]。
殺手锏一:銅離子可控釋放與銅死亡誘導
首先,癌細胞內化 RC NPs 后,胞內 ROS 水平和銅離子濃度顯著增加。蛋白質印跡 (Western blot) 顯示,鐵硫簇蛋白 FDX1、ACO2、SDHB 的表達水平顯著下調,直接抑制三羧酸循環 (TCA cycle) 關鍵酶活性,導致能量代謝崩潰。隨后,共聚焦激光掃描顯微鏡 (CLSM) 觀察到,銅死亡關鍵標志物 DLAT 在細胞質中形成顯著聚集斑塊 (紅色熒光信號增強) ,證實脂酰化蛋白異常聚集。并且,生物透射電鏡 (Bio-TEM) 顯示,RC NPs/US 處理的腫瘤細胞線粒體出現嵴結構減少、膜密度增高及整體萎縮,表明線粒體功能嚴重受損。
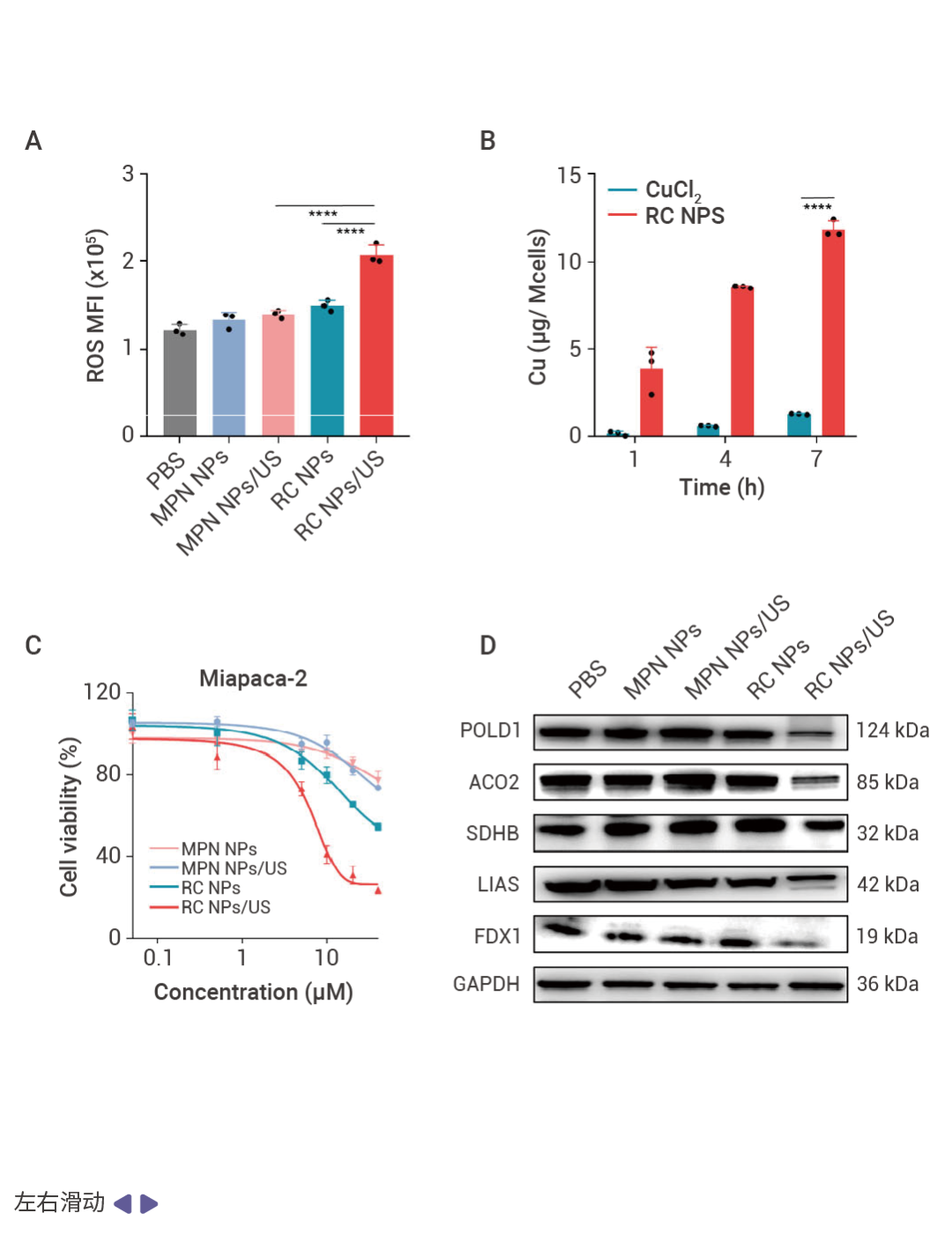
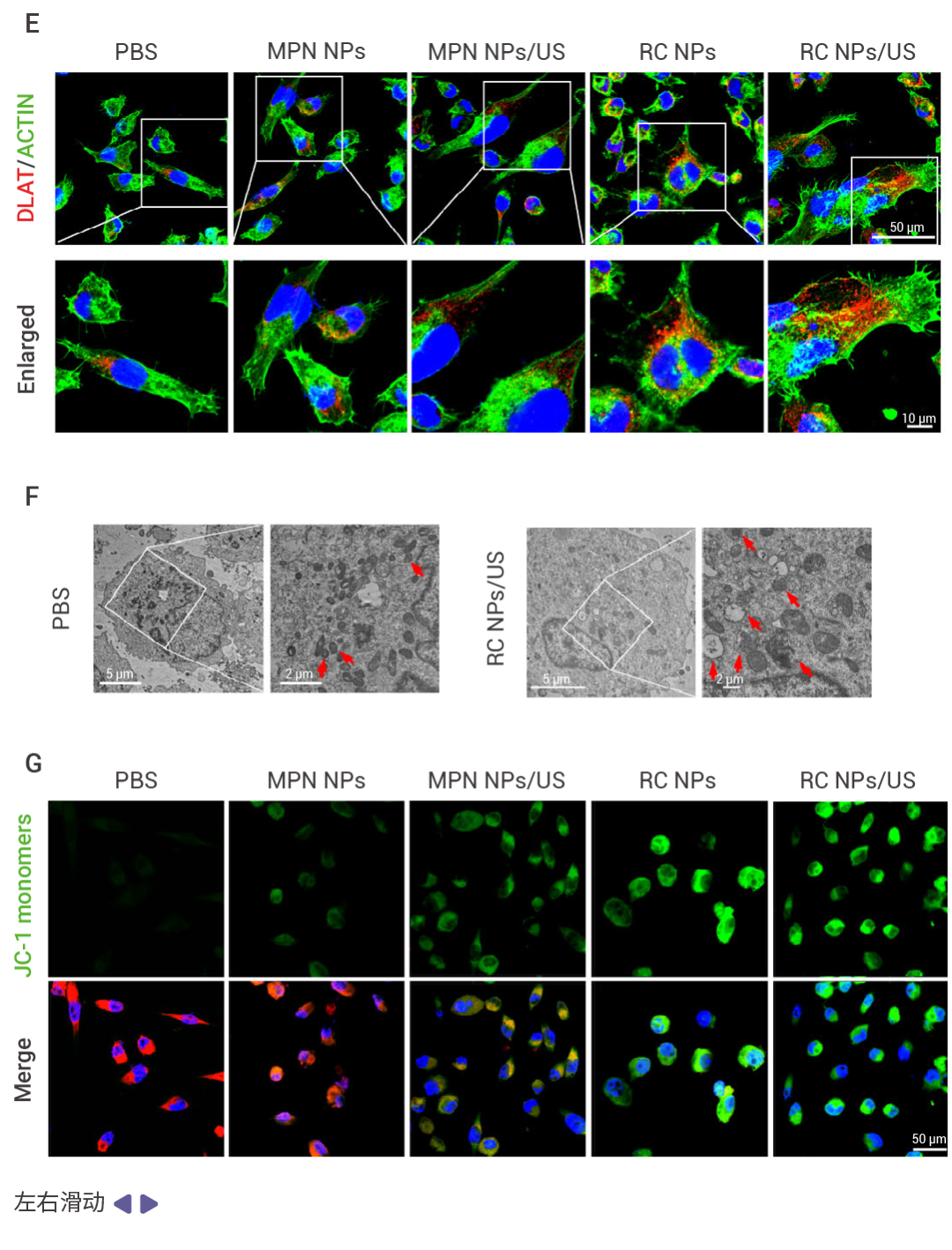
圖 2. RC NPs 的胞內抗癌特性 [1] 。
A-C:RC NPs 能夠有效地將癌細胞內化,增加胞內 ROS 水平和銅離子濃度,抑制細胞活力。RC NPs/US 處理后的 Miapaca-2 細胞中,ROS 生成量分別比 RC NPs 和 MPN NPs/US 處理后高4.0 倍和 3.4 倍(A);且 Miapaca-2 細胞中的 Cu 含量是經CuCl 2 處理的細胞中的 9.1 倍 (B);由此,20 μM RC NPs/US 處理的 Miapaca-2 細胞存活率僅為 28% (IC 50 =8.7 μM) (C)。D-E:RC NPs 通過誘導脂酰化蛋白質的聚集和鐵硫簇蛋白的還原,誘導銅死亡。RC NPs/US 處理下調了鐵硫簇蛋白(如 POLD1、ACO2、SDHB、LIAS 和 FDX1)的表達水平 (D);并且,DLAT 在細胞質中顯著聚集,標志銅死亡的發生 (E)。F-G:RC NPs 靶向癌細胞線粒體并抑制線粒體膜電位。RC NPs/US 處理胰腺癌細胞 Miapaca-2,線粒體形態大多萎縮,線粒體嵴減少甚至消失,線粒體膜密度增加 (F);同時,細胞的線粒體膜電位發生改變,JC-1 無法在線粒體基質中聚集,呈現強綠色熒光和弱紅色熒光 (G)。
殺手锏二:激活 ICD 介導的抗癌免疫反應和免疫微環境
研究發現,RC NPs 觸發 ICD 特征性分子 DAMP 釋放。DAMP 主要包括鈣網蛋白 (CRT) 外翻、ATP 和高遷移率族蛋白 B1 (HMGB1) 釋放。 CLSM 和流式細胞術 (FCM) 定量結果顯示,RC NPs/US 處理的 Miapaca-2 細胞膜表面 CRT 熒光強度和表達較對照組提升,標志著 ICD 的啟動。ELISA 檢測到 Miapaca-2 細胞培養上清中 HMGB1 濃度上升,FCM 顯示 ATP 釋放量增加,二者協同促進抗原呈遞細胞 (APC) 的募集與活化。
并且,RC NPs 同時介導免疫效應細胞的系統性激活,促進樹突狀細胞 (DC) 成熟和巨噬細胞極化重編程。 FCM 顯示,與 RC NPs/US 處理的腫瘤細胞共培養后,骨髓來源樹突狀細胞 (BMDC) 的成熟率顯著提升,其抗原呈遞能力顯著增強。RC NPs/US 處理后, M1 型巨噬細胞 (CD80+) 比例較對照組顯著提升,且 M2 型標志物 CD206 表達顯著降低,促進 M2 型向 M1 型轉化,表明免疫抑制微環境向促炎狀態逆轉。
此外,RC NPs 介導系統性 T 細胞免疫激活與免疫抑制微環境重塑,增強 T 細胞浸潤與免疫監視。 RC NPs/US 顯著增加 Panc 02 皮下瘤模型中 CD8? T 細胞比例和浸潤率,CD8? T 細胞占比較對照組增加 2.2 倍。提升腫瘤組織中 NK 細胞比例,較 PBS 組 (5.24%) 增加近 3 倍。降低腫瘤內 Treg 細胞比例,使其顯著低于 PBS 組 (7.9%)。
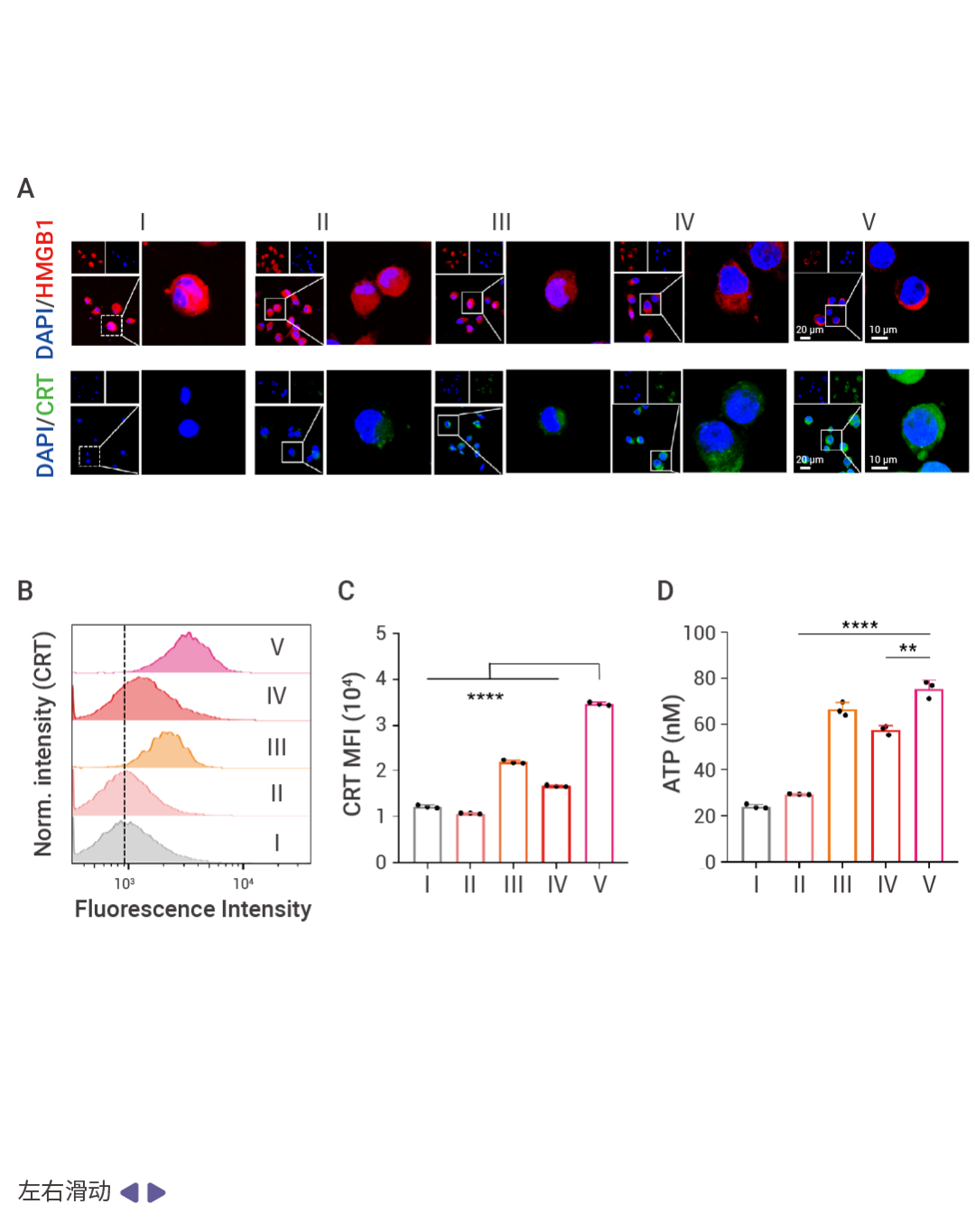
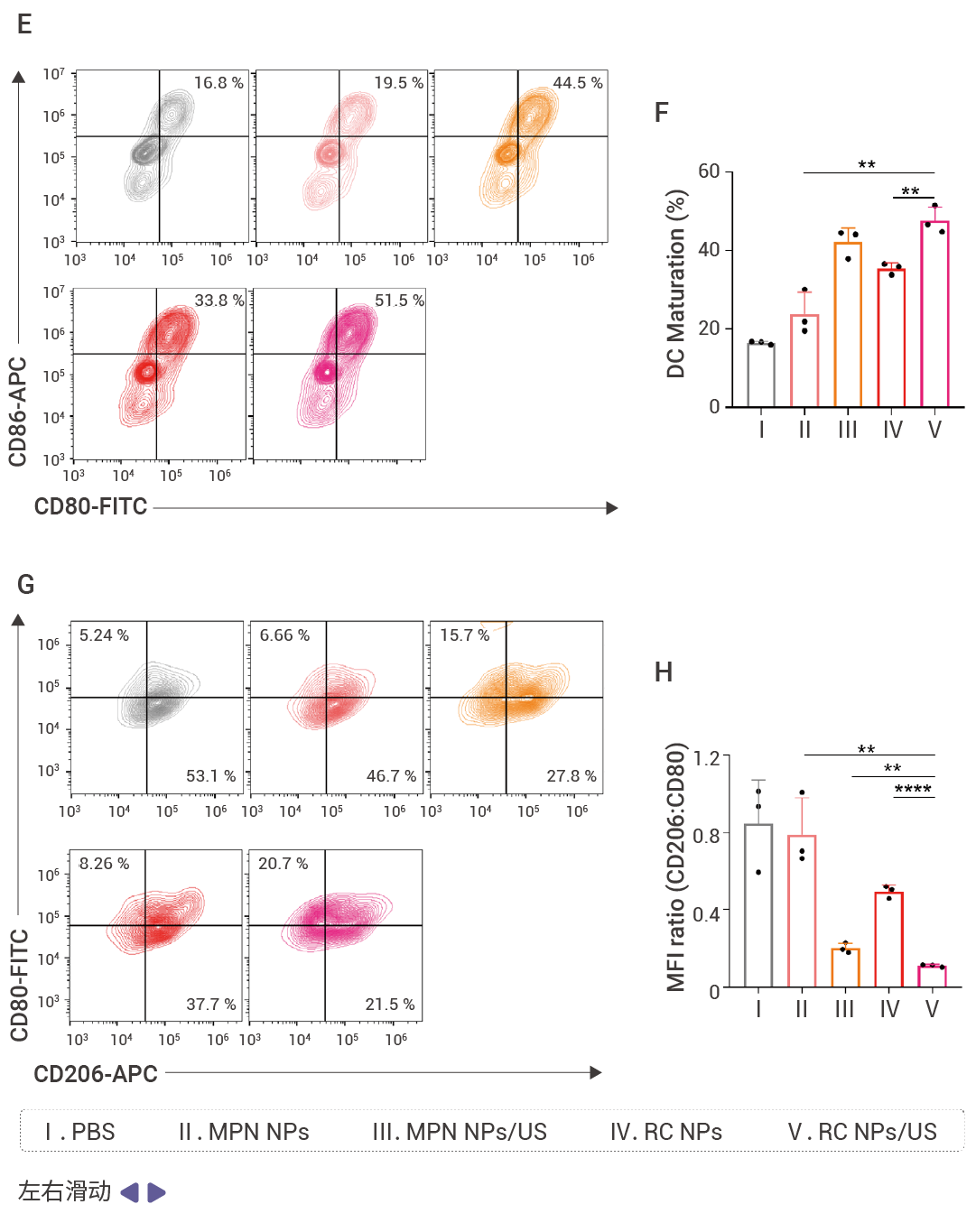
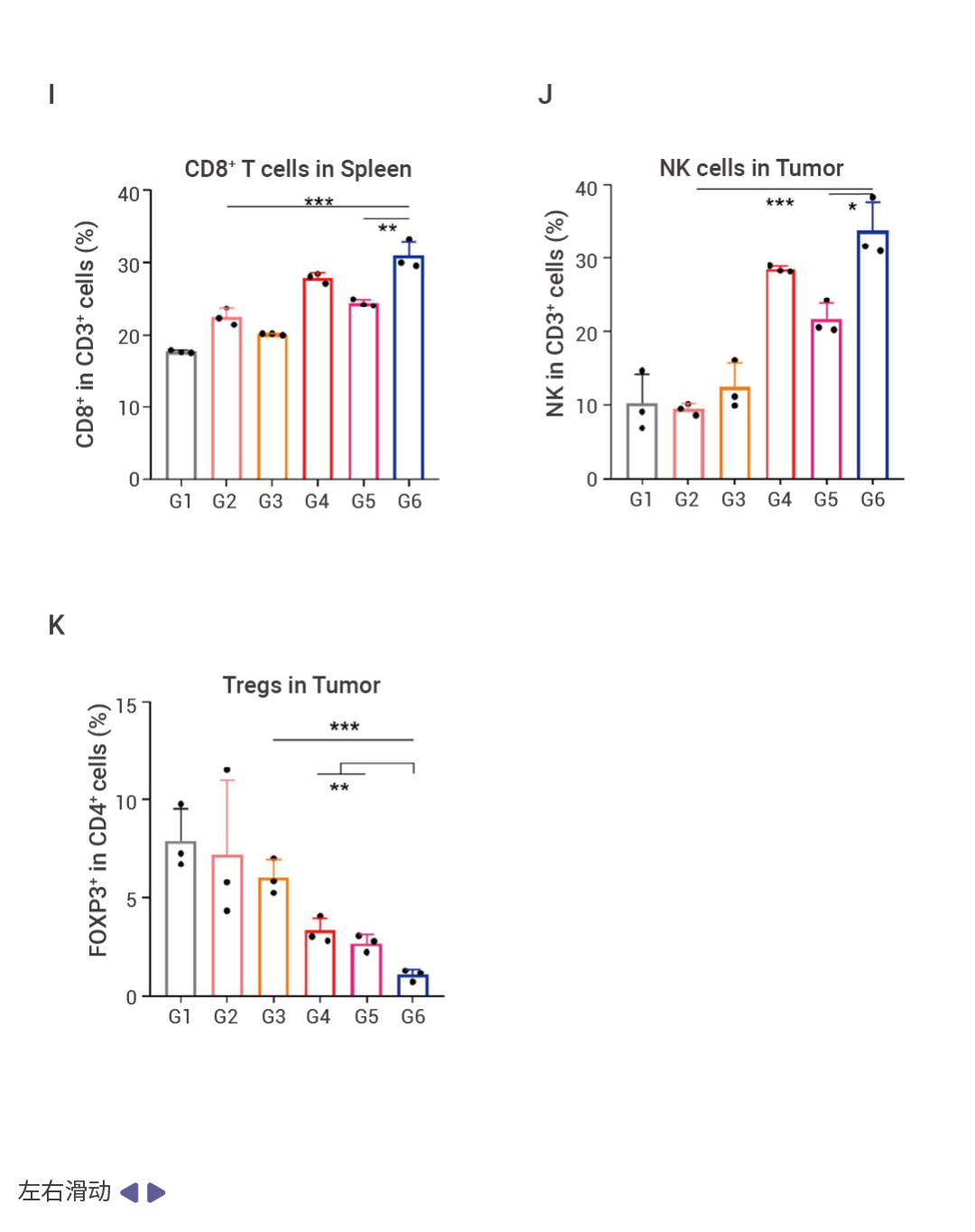
圖 3. RC NPs 可引發腫瘤特異性免疫反應 [1] 。
A-D:RC NPs 有效激活 DAMP,活化免疫反應。RC NPs 誘導 Miapaca-2 細胞的 CRT 向細胞膜遷移,使其暴露在細胞表面,并增加癌細胞核中 HMGB1 釋放 (A)。RC NPs 處理,使 Miapaca-2 細胞的 CART 的流式細胞術曲線面積 (B) 和 FCM 分析指數增加 (C),產生的 ATP 量是 RC NPs 處理的細胞的 1.3 倍 (D)。E- H:RC NPs/US 誘導 DC 成熟,成熟 DC 細胞(CD80 + CD86 + )數量增加 (E-F);NPs/US 并誘導的巨噬細胞從 M2 極化到 M1。I-K:RC NPs/US 激活腫瘤和淋巴結的免疫反應。RC NPs/US 增強 T 細胞免疫,增加 CD80 + CD86 + 細胞占比 (I),活化并增強 NK 細胞的抗腫瘤反應 (J),降低小鼠的腫瘤組織中 Treg 細胞的比例 (K)。
Section.03
RC NPs 改寫胰腺癌小鼠命運
RC NPs 憑借超聲激活的“雙殺絕技”——銅死亡誘導與免疫激活,或能改寫胰腺癌荷瘤小鼠的生存命運。在 C57BL/6 小鼠胰腺癌 Panc 02 皮下腫瘤模型中,通過尾靜脈給藥,可觀察到 RC NPs 在腫瘤部位積聚。在熒光成像引導下,鎖定位置執行超聲治療。RC NPs 誘導腫瘤發生銅死亡,發揮出顯著且優于 Gemcitabine(GEM) 的腫瘤抑制率 (抑制率達 90%)[1]。
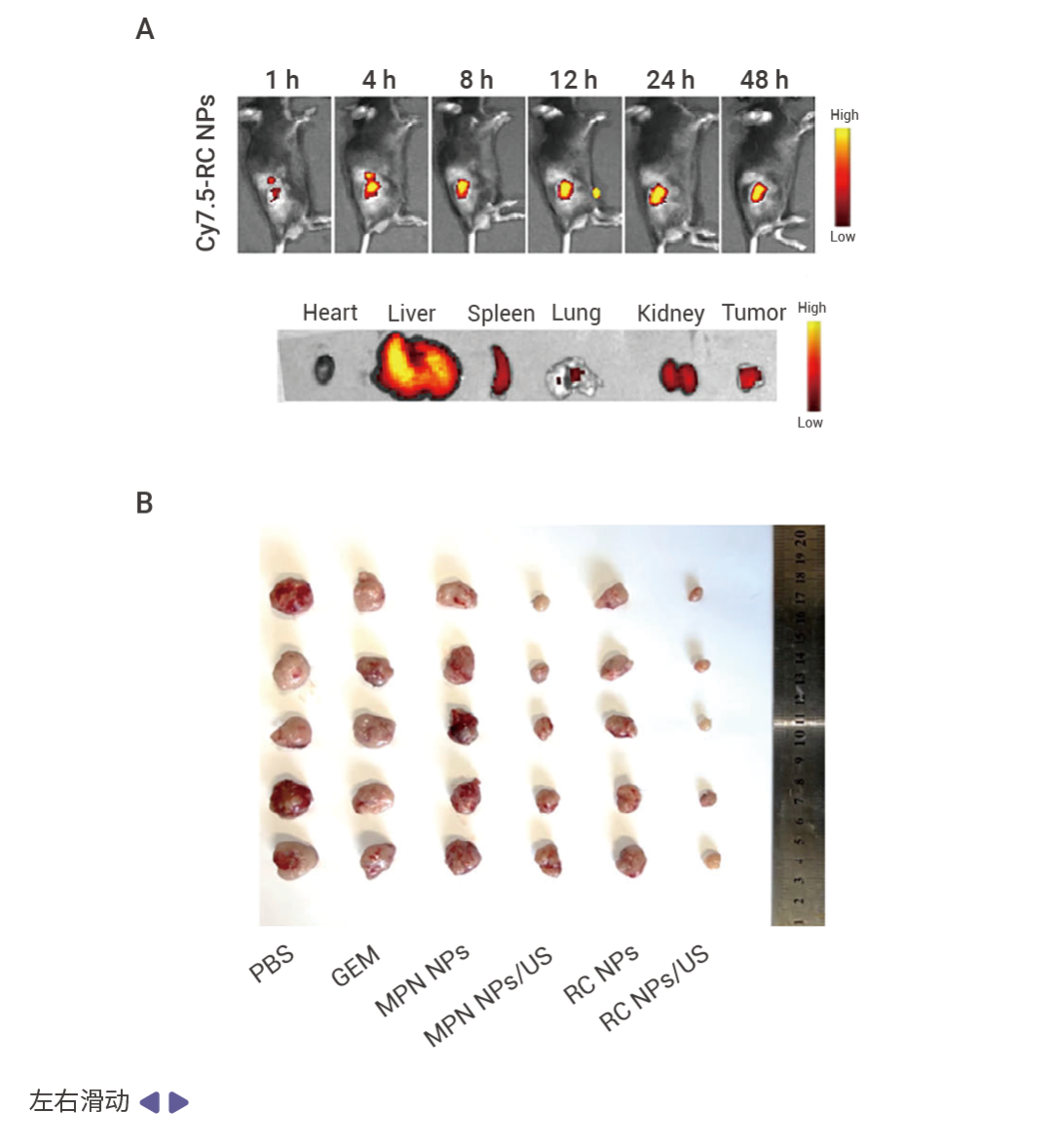
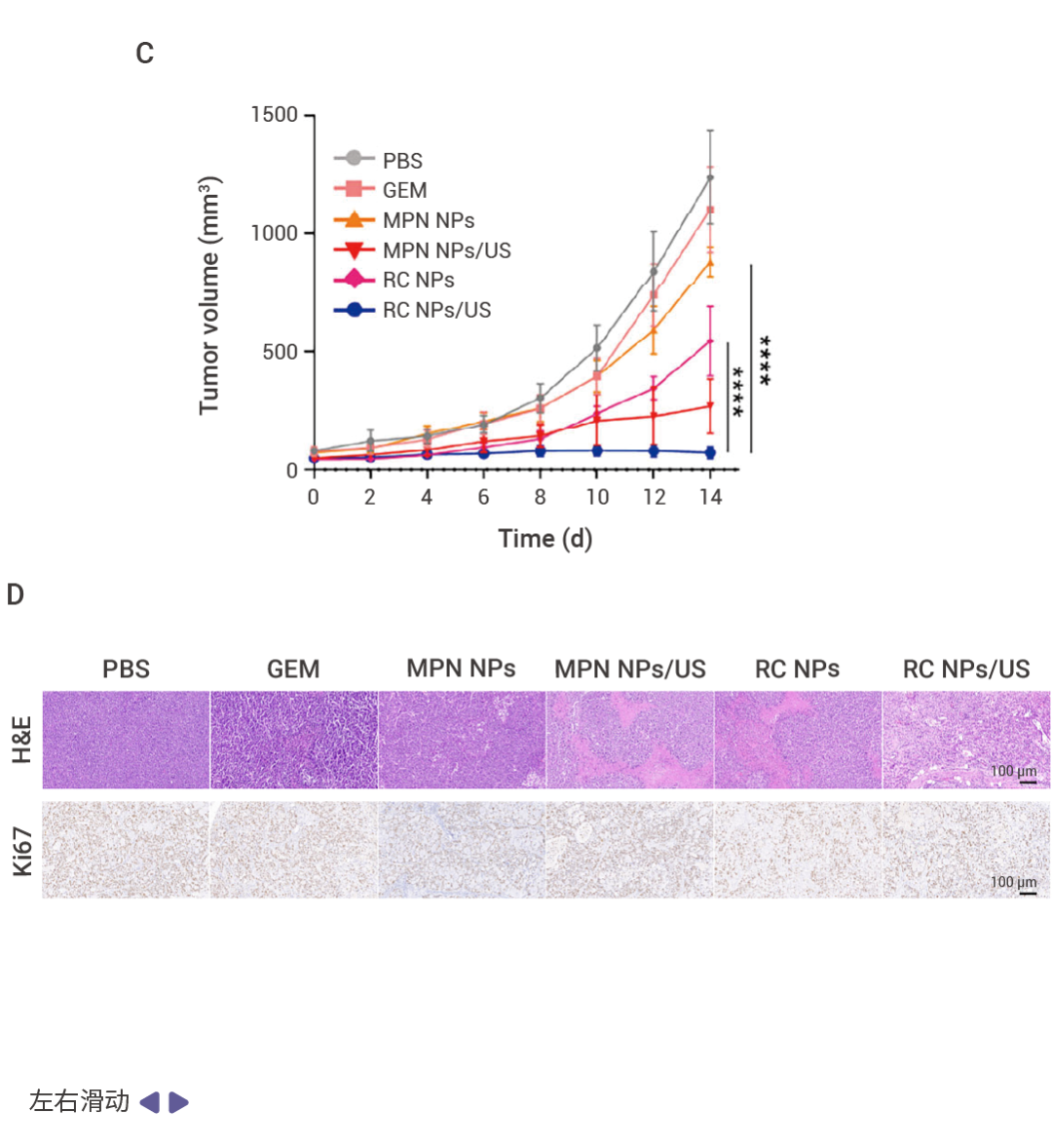 圖 4. RC NPs 聯合 SDT 在胰腺癌皮下模型中的抗腫瘤效果
[1]
。
圖 4. RC NPs 聯合 SDT 在胰腺癌皮下模型中的抗腫瘤效果
[1]
。
A-C:RC NPs/US 的體內成像和抗腫瘤特性。不同時間點靜脈注射 Cy7.5-RC NPs 后的生物分布和離體成像,熒光信號在 24 h 時達到峰值 (A)。經尾靜脈向小鼠體內注射 PBS、Gemcitabine (GEM)、MPN NPs、MPN NPs/US、RC NPs 和 RC NPs/US, 再進行超聲治療。RC NPs/US 處理組的腫瘤大小顯著小于其他處理組 (B),顯示出顯著的腫瘤治療效果,腫瘤抑制率約為 90% (C)。D:腫瘤切片的 H&E 和 Ki67 染色結果顯示,接受 RC NPs/US 治療的小鼠的腫瘤細胞增殖受到顯著抑制,圖 4 腫瘤組織出現廣泛的細胞核收縮、碎裂和缺失。
在小鼠胰腺癌原位模型 (Panc 02-Luciferase 細胞胰腺注射) 和基于臨床患者來源異種移植 (PDX) 模型中,RC NPs/US 實現了 “從絕境到希望” 的跨越 [1] 。
在小鼠胰腺癌原位模型中 ,RC NPs/US 組腫瘤生長速度顯著低于對照組;免疫分析表明,腫瘤內成熟樹突狀細胞 (CD80? CD86?) 比例提升至 41.2%,CD8? T 細胞浸潤率提升至 25.1%,形成強烈的抗腫瘤免疫應答,讓免疫系統記住癌細胞特征,預防復發。RC NPs/US 在原位腫瘤模型中實現了高效低毒的治療效果。
在小鼠 PDX 模型中 ,傳統治療組 (PBS、GEM) 小鼠均在 40 天內死亡,而 RC NPs/US 組 80% 小鼠存活超過 60 天,部分個體甚至實現腫瘤完全消退。30 天療程結束時,RC NPs/US 組腫瘤體積僅為初始體積的 1.2 倍,而對照組腫瘤體積增長 15 倍以上。RC NPs/US 在高度模擬臨床腫瘤微環境的 PDX 模型中可有效抑制腫瘤生長并提高生存率 (SR)。
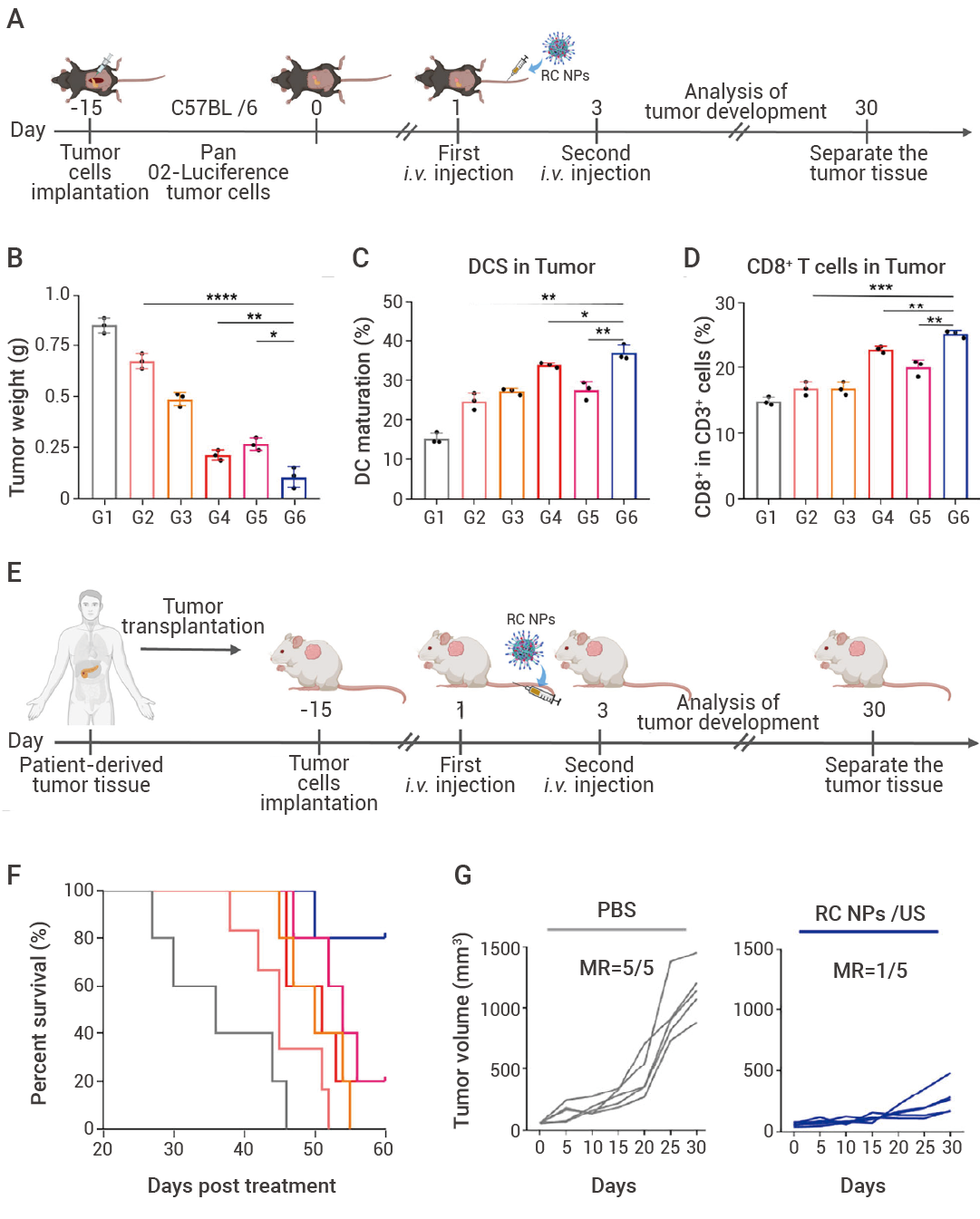 圖 5. RC NPs 聯合 SDT 在胰腺癌皮下模型和 PDX 模型中的抗腫瘤效果
[1]
。
圖 5. RC NPs 聯合 SDT 在胰腺癌皮下模型和 PDX 模型中的抗腫瘤效果
[1]
。
A-D:RC NPs 在小鼠胰腺癌原位模型中的體內抗腫瘤效果。通過將表達熒光素酶的 Panc 02 細胞原位注射到小鼠胰腺中建立模型,模型建立成功后分兩次經尾靜脈注射 RC NPs (A)。加入超聲治療后,RC NPs/US 有效抑制腫瘤生長,平均腫瘤重量僅為 GEM 組和 RC NPs 組小鼠的 1/6 和 1/2 (B);并增加腫瘤中成熟 DC 細胞數量 (C) 和 CD8 + T細胞浸潤率 (D)。 RC NPs 治療期間小鼠的體重沒有出現明顯變化。E-G:RC NPs 在患者來源異種移植(PDX)模型的體內抗腫瘤效果。將臨床胰腺患者新鮮的小塊腫瘤組織皮下移植到小鼠體內,建立 PDX 模型。分別在第 1 天和第 3 天通過尾靜脈向小鼠體內注射治療劑 (E)。結果顯示,RC NPs/US 有效抑制了腫瘤的生長,小鼠的生存率明顯長于其他組 (F);且 RC NPs/US 組的小鼠腫瘤體積顯著小于對照組 (G)。
SDT+ 納米顆粒的玩法可以很好的適用于深度實體腫瘤 (如肝癌、膠質母細胞瘤) 和耐藥腫瘤 (阿霉素耐藥 U87 細胞) 。還可以加入聯合治療套餐,擴大治療面。比如 SDT+ 免疫治療,誘導 ICD 后聯合 PD-L1 抗體,或能使 CD8? T 細胞浸潤率顯著提升。或 SDT+ 基因治療,通過超聲靶向遞送 siRNA,沉默腫瘤相關基因 (如 MDR1) ,逆轉化療耐藥。
SDT 的技術優勢[1][2]:
? 精準可控:通過調節超聲參數 (頻率、強度、脈沖模式),可實現腫瘤局部的精準激活,避免引起全身毒性。避免引起全身毒性、"誤殺” 健康細胞。
? 深層穿透:超聲波作為機械波,穿透深度顯著優于光動力療法 (PDT) 的光源 (如可見光 / 近紅外光),可到達深層腫瘤組織 (如肝臟、胰腺等深部器官),適用于治療傳統療法難以觸及的實體瘤。
Section.04
小結
本期文章解讀,介紹了 RC NPs 在胰腺癌皮下模型、原位模型及患者來源異種移植 (PDX) 模型中的顯著抑瘤效果。同時熒光成像和流式細胞術實驗也證實了 RC NPs 的良好生物安全性和免疫激活能力。這一成果不僅攻克了傳統銅遞送系統時空控制不足和全身毒性的難題,更開辟了聲動力療法與新型細胞死亡機制聯合應用的新方向,為臨床轉化提供了極具潛力的候選方案。或許不久的將來,無創、精準的納米療法會成為抗癌標配,讓更多‘不治之癥’變成‘可治之癥’!”
| 產品推薦 |
| 1,3-Diphenylisobenzofuran (DPBF) (HY-W011664) 檢測單線態氧 (1O2) 的生成,驗證聲敏劑 RBB 的活性。 |
| 標記 RC NPs (Cy5.5-RC NPs),通過流式細胞術 (FCM) 監測腫瘤細胞 (如 Miapaca-2) 對納米顆粒的攝取效率。 |
| 標記 RC 納米顆粒 (Cy7.5-RC NPs),通過體內成像系統 (IVIS) 監測納米顆粒在腫瘤模型中的生物分布及富集情況。 |
| 2',7'-Dichlorodihydrofluorescein diacetate (DCFH-DA) (HY-D0940) ROS 探針,通過綠色熒光強度變化可視化和半定量分析腫瘤細胞內活性氧 (ROS) 的生成水平。 |
| Rhodamine B hydrazide (RBH) (HY-123645) 檢測腫瘤細胞內銅離子 (Cu2+) 的濃度,綠色熒光強度與胞內 (Cu2+) 濃度呈正相關。 |
| 5,5',6,6'-Tetrachloro-1,1',3,3'-tetraethylbenzimidazolylcarbocyanine iodide (JC-1) (HY-15534) 通過紅綠熒光比例變化評估線粒體膜電位變化,反映線粒體功能損傷及銅死亡進程。 |
| 抗腫瘤劑,可抑制 DNA 合成和修復,導致細胞自噬 (autophagy) 和凋亡 (apoptosis)。 |

[1] Huang J, et al. Ultrasound-Triggered Nanoparticles Induce Cuproptosis for Enhancing Immunogenic Sonodynamic Therapy. Adv Mater. 2025 May 13:e2504228.
[2] Gong Z, et al. Design and Challenges of Sonodynamic Therapy System for Cancer Theranostics: From Equipment to Sensitizers. Adv Sci (Weinh). 2021 Mar 12;8(10):2002178.


本站“ABIO生物試劑品牌網”圖片文字來自互聯網
如果有侵權請聯系微信: nanhu9181 處理,感謝~