空間多組學助力還原邊界性卵巢癌建立侵襲的能力_abio生物試劑品牌網
題目:Spatial proteo-transcriptomic profiling reveals the molecular landscape of borderline ovarian tumors and their invasive progression
期刊:Cancer Cell
IF:44.5
DOI:10.1016/j.ccell.2025.06.007
研究背景
低級別漿液性卵巢癌(LGSC)是一類起源于漿液性邊界性腫瘤(SBT)的惰性惡性腫瘤,臨床表現為生長緩慢、轉移廣泛,但對傳統化療反應差、預后差。盡管SBT與LGSC共享部分突變特征(如KRAS/BRAF/ERBB2),但兩者之間具體的轉化路徑和調控機制仍不清楚,尤其是SBT中部分具有微乳頭結構的中間態病灶是否預示著更高風險,以及浸潤性LGSC如何在空間層面逐步建立侵襲能力。
本研究采用空間轉錄組平臺GeoMx DSP和空間蛋白組平臺,系統地描繪了SBT向LGSC演化的空間分子圖譜,并聚焦于上皮細胞、腫瘤基質及其交互的空間轉錄特征,重構惡性腫瘤進展過程中的關鍵通路及潛在靶點,為轉化性治療策略提供了新的分子依據。
實驗設計與技術手段
研究納入來自多位患者的代表性卵巢腫瘤樣本,覆蓋漿液性腫瘤演化過程中的關鍵階段,包括:
邊界性漿液性腫瘤(SBT):4位患者;
微乳頭型SBT(SBT-MP):4位患者,具有更高癌變風險的中間態;
原發性低級別漿液性癌(LGSC-PT):3位患者;
轉移性LGSC(LGSC-Met):來自3位LGSC-PT患者的配對轉移灶,主要分布于網膜等遠端區域。
所有樣本采用連續切片,在空間蛋白組平臺分析特定細胞類型(上皮和 基質)的蛋白表達譜,以及在GeoMx DSP平臺上選取特征區域(ROI),分別對上皮區與基質區進行空間轉錄分析。通過對比不同病理階段和組織區域之間的表達差異,構建空間演化軌跡,并識別關鍵通路與潛在靶點。
主要發現
1. 邊界性腫瘤向低級別漿液性癌的空間分子演化路徑
研究明確描繪了從SBT → 微乳頭型SBT(SBT-MP)→ LGSC → 轉移灶的一條空間演化路徑。特別是在SBT-MP階段,空間轉錄組數據顯示,MAPK通路、c-MET 以及ERF、SRC等促遷移信號顯著上調,為后續惡性轉化奠定基礎。
空間表達模式顯示,從SBT到LGSC,腫瘤上皮區域逐步激活促增殖與促遷移基因簇,提示SBT-MP具有明確的“癌變中間體”特征。
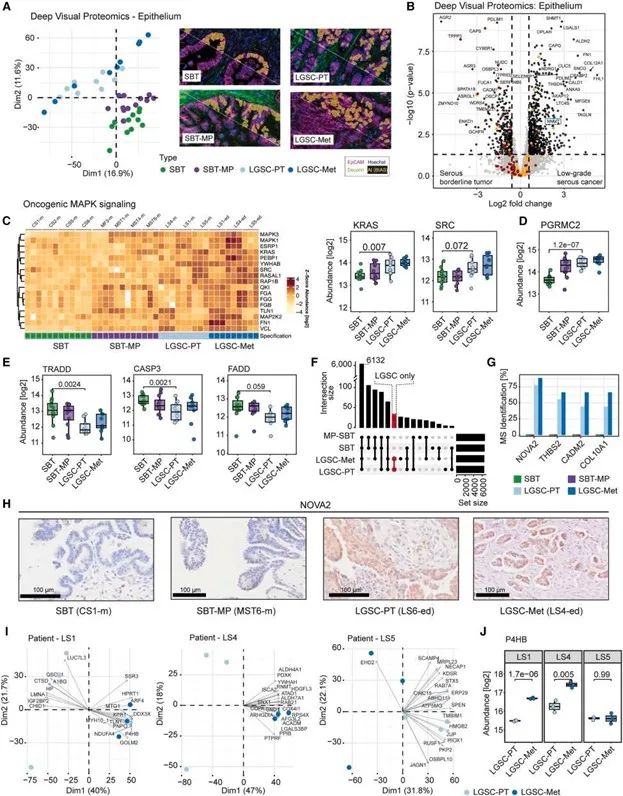 邊界性腫瘤向LGSC演化的空間路徑
邊界性腫瘤向LGSC演化的空間路徑
2. 癌細胞與基質細胞協同進化,形成跨區室的促遷移信號網絡
在LGSC進展過程中,空間轉錄組揭示了腫瘤上皮細胞與基質細胞間的動態聯動變化,形成協同的促遷移狀態:上皮細胞出現類神經特征基因(如NOVA2、SNCG、SLIT2)的激活,提示其獲得類似神經遷移的功能;基質區域顯著富集成纖維細胞活化相關基因(如NNMT、MMP14、SPARC),提示形成促癌CAF表型;上皮與基質間形成互作配對(如FN1–整合素、MMP14–SDC1等),構建促遷移信號軸,空間鄰接區域表達高度協同。
這一空間信號協作網絡說明,LGSC并非癌細胞單獨演化的結果,而是腫瘤----基質間長期協同作用塑造的結果。
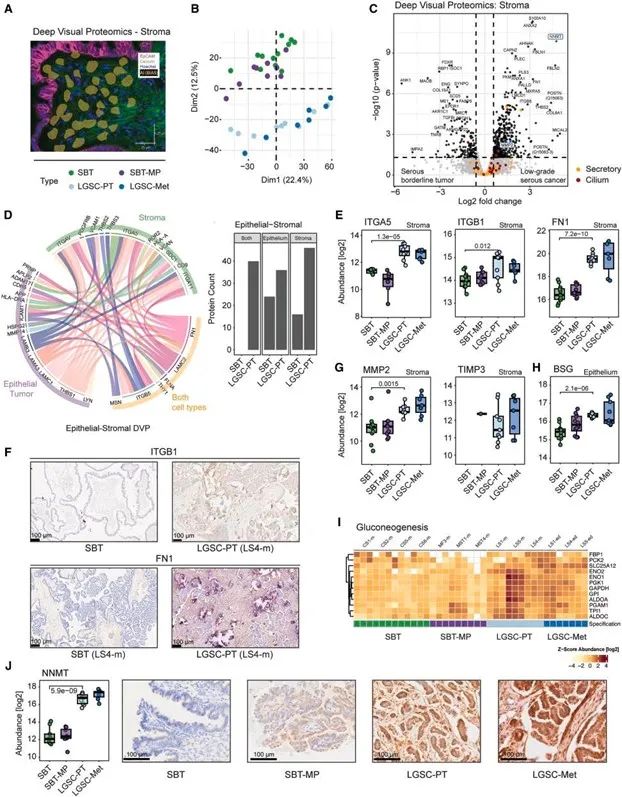 上皮細胞–基質細胞協同構建遷移信號網絡
上皮細胞–基質細胞協同構建遷移信號網絡
3. 識別CDK4/6與FOLR1為可轉化治療靶點,聯合治療顯著抑制LGSC進展
結合空間表達趨勢與多組學整合分析,研究鎖定了兩個高表達的潛在治療靶點:CDK6 與 FOLR1。在LGSC小鼠模型中,CDK4/6抑制劑 milciclib 與 FOLR1抗體偶聯藥物 mirvetuximab soravtansine 聯合使用,顯著抑制腫瘤體積、腹水及遠端轉移。研究提供了具有臨床可轉化前景的靶向組合方案,尤其適用于當前缺乏有效治療方案的LGSC患者。
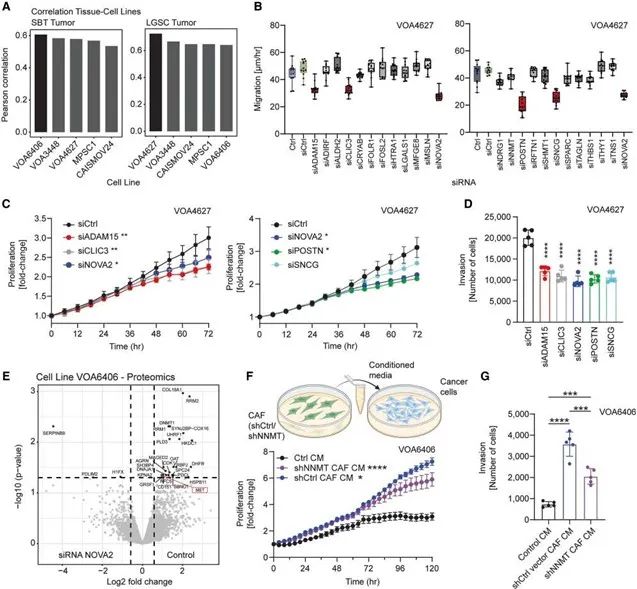 CDK6與FOLR1聯合靶向治療驗證
CDK6與FOLR1聯合靶向治療驗證
總結
本研究借助GeoMx DSP空間轉錄組平臺和空間蛋白檢測技術,首次系統構建了SBT向LGSC進展的多階段空間圖譜。揭示了微乳頭結構在轉化過程中的生物學意義,發現腫瘤與基質細胞通過空間協同演化形成促遷移信號軸,并識別出可被藥物靶向的關鍵分子,如NOVA2、NNMT、FOLR1等。研究不僅深化了對LGSC空間病理機制的理解,也為臨床上精準識別高危SBT病灶與個性化治療提供了全新思路與空間分子依據。
本站“ABIO生物試劑品牌網”圖片文字來自互聯網
如果有侵權請聯系微信: nanhu9181 處理,感謝~