特異性KRAS G12D抑制劑在癌癥治療中的應用_abio生物試劑品牌網
Section.01
KRAS 突變和癌癥
KRAS 基因突變在癌癥中頻發,包括胰腺導管腺癌、非小細胞肺癌和結直腸癌等 [1][2] 。最常發生的激活突變是在密碼子 12 (G12) 、13 (G13) 、和 61 (Q61) 上的單核苷酸置換,其中絕大多數突變發生在 G12 上,G12D、G12C 和 G12V 則是最常見的突變亞型 [2][3] 。G12C 突變阻斷 GAP 與 KRAS 的結合,從而抑制 GTP 水解并將 G12C 突變體 KRAS 鎖定在其活性狀態。活性 KRAS 通過 MAPK 和 PI3K 途徑誘導信號轉導,促進細胞增殖、生長和存活,從而促進腫瘤發生 [1][4] 。G12V 是第二常見的 KRAS 突變,它會導致 MAPK 通路的異常激活,并促進腫瘤的發生和轉移。
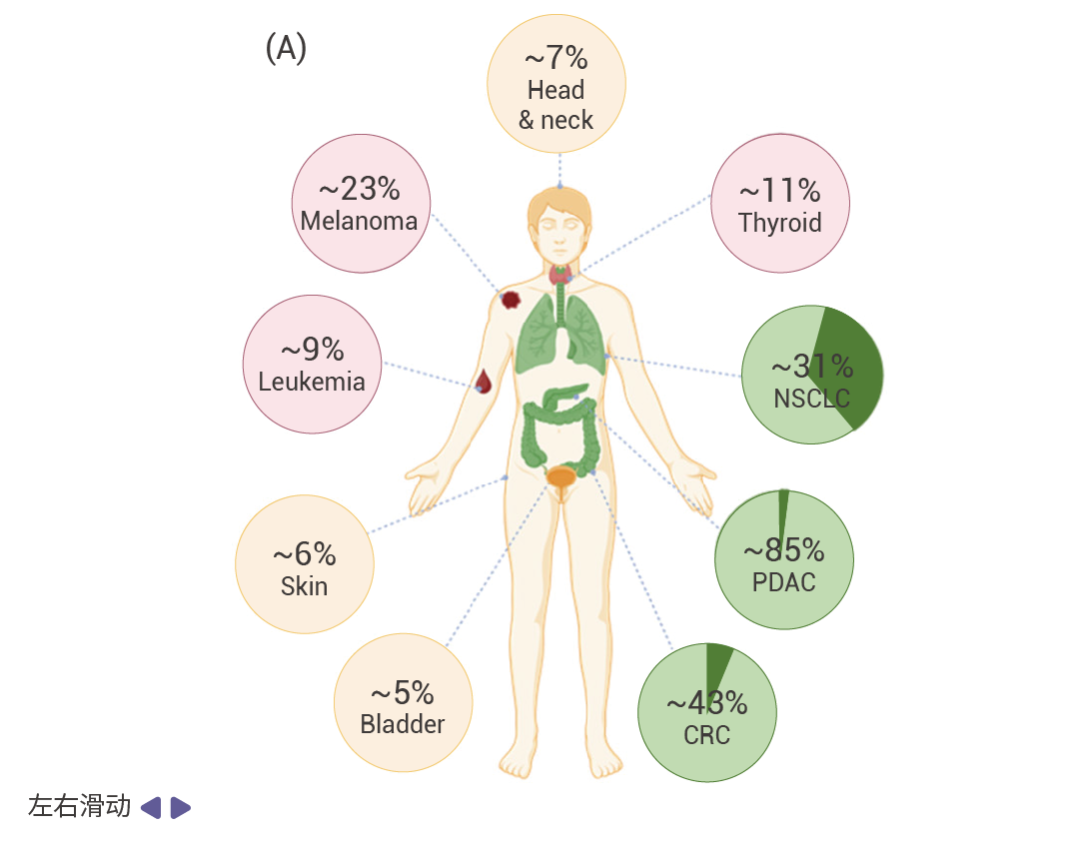
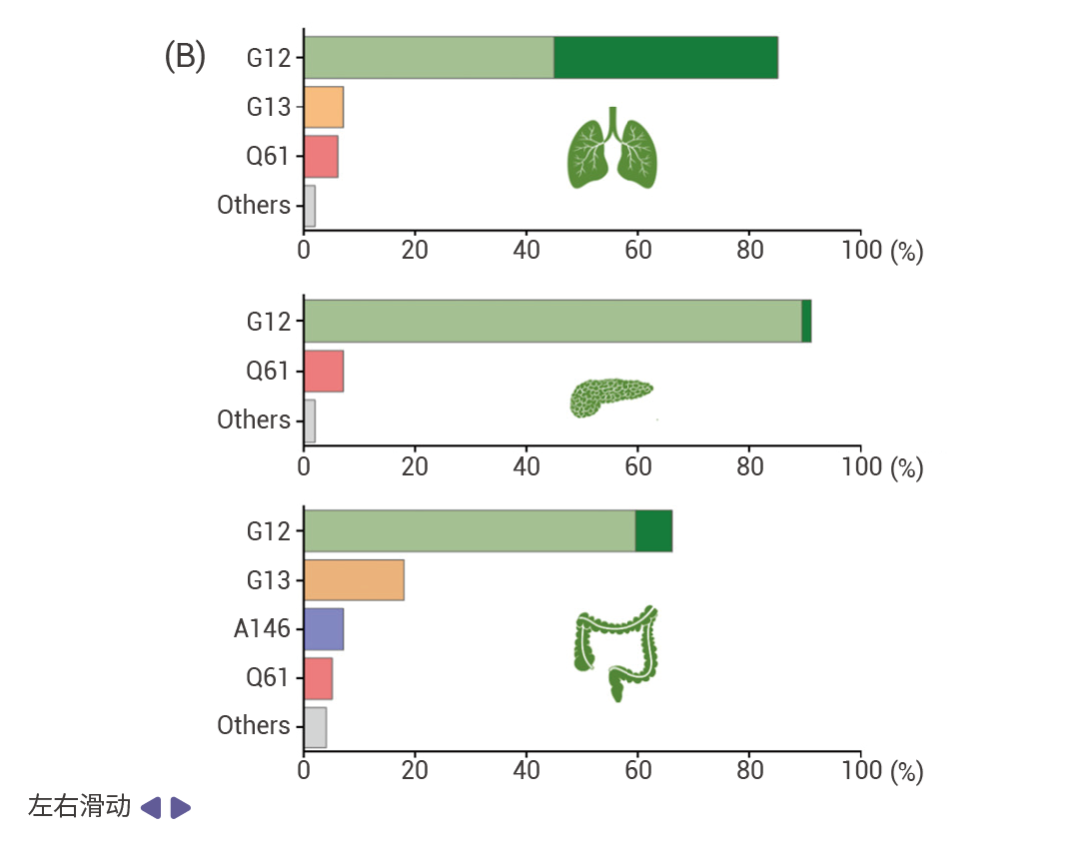
圖 1. RAS 突變在各種主要癌癥類型中的發生率 [5] 。
A.不同主要癌癥類型中 KRAS (綠色), HRAS (黃色),和 NRAS (粉色) 突變頻率的分布情況。 B. KRAS 突變亞型在癌癥中的發生頻率:上為非小細胞肺癌;中為胰腺導管腺癌;下為結直腸癌。
KRAS 屬于大鼠肉瘤病毒癌基因 (Rat sarcoma viral oncogene family, RAS) 的家族成員之一,可將 GTP 水解為 GDP。在正常生理條下,在非活性 GDP 結合狀態和活性 GTP 結合狀態之間循環,將細胞外信號轉導至細胞內部。受體酪氨酸激酶 (RTK) 激活后,鳥苷酸交換因子 (GEF) 與 KRAS 結合并促進結合的 GDP 交換為 GTP,從而將 KRAS 切換到活性狀態[6]。GAPs 通過加強 GDP 和 KRAS 之間的結合來維持 KRAS 的非活性狀態。
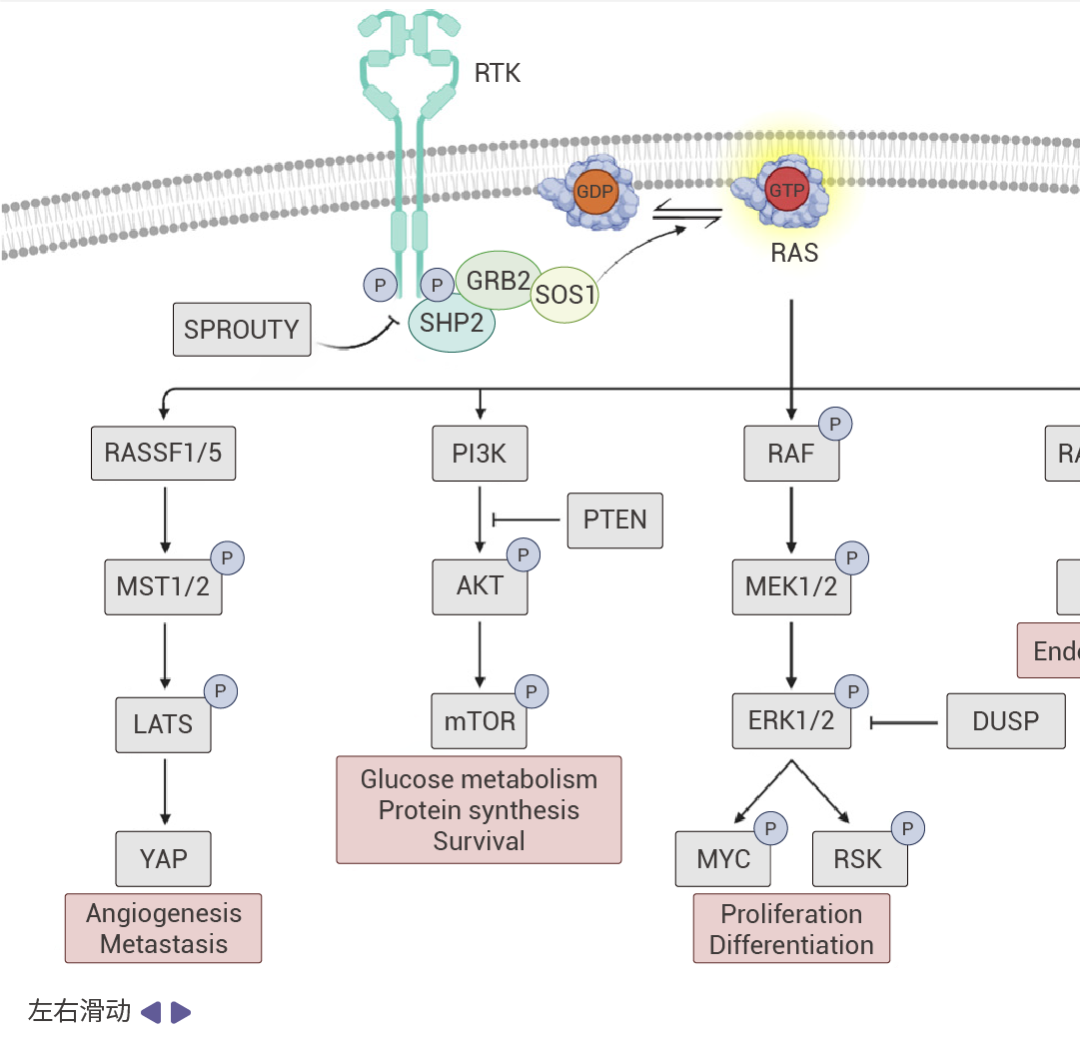
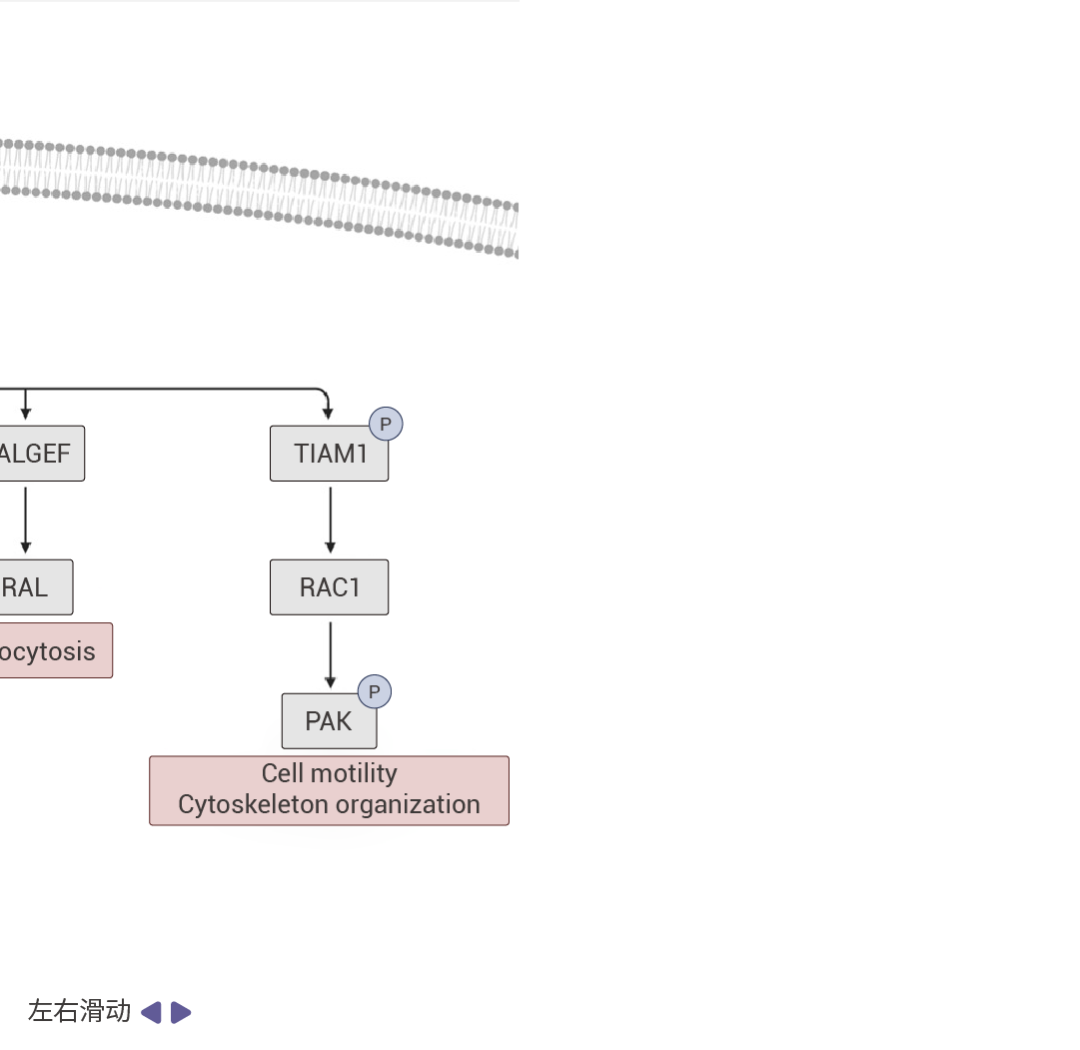
圖 2. RAS 信號通路 [5] 。
受體酪氨酸激酶(RTKs)通過促進 GEF(如 SOS1)將 GDP 換成 GTP 的過程來促進 RAS 蛋白的激活。活躍的 RAS 會驅動眾多促癌通路。
Section.02
成功靶向 KRAS G12C
KRAS 體積較小,表面光滑,導致小分子難以與 KRAS 結合。KRAS 表面除了 GTP 結合袋外,沒有其他區域可以與小分子結合,但靶向 GTP 結合袋相當困難 [1] 。因此長久以來 KRAS 都被認為是 “不可成藥” 的靶點。
switch-II 口袋的發現促進了臨床應用的特異性 KRAS 抑制劑的發展,目前特異性 KRAS G12C 的抑制劑已被引入臨床實踐,其中 Sotorasib (AMG510) 和 Adagasib (MRTX849) 分別于 2021 年和 2022 年被 FDA 批準上市, Fulzerasib (GFH925) 在 2024 年首次獲得中國批準。這 3 種藥物被用于 KRAS G12C 突變的非小細胞肺癌 (NSCLC) 的治療。
Sotorasib 和 Adagasib 的單藥治療在結直腸癌中的客觀緩解率 (ORR) 均顯著低于非小細胞肺癌。研究表明 EGFR 的激活是導致結直腸癌緩解率較低的原因之一,而同時使用 EGFR 抑制劑與 BRAF 抑制劑聯合治療則能夠克服這一問題 [7] 。Sotorasib 與 Panitumumab ( 一種 EGFR 抑制劑) 聯合使用可將無進展生存期 (PFS) 提高至 5.6 個月,而接受 trifluridine-tipiracil (三氟尿苷-替吡嘧啶) 或 Regorafenib (多靶點受體酪氨酸激酶抑制劑,抑制 VEGFR1/2/3,PDGFRβ,Kit,RET 和 Raf-1) 治療的 KRAS G12C 突變型晚期結直腸癌患者組的 PFS 僅為 2.2 個月 [8] 。Adagrasib 與 Cetuximab (一種 EGFR 抑制劑) 聯合使用時,客觀緩解率也有所提高,達到 30.2% [9] 。基于這些發現,FDA 于 2024 年批準了這種聯合療法用于 KRAS G12C 突變型結直腸癌。
此外,目前幾種間接的泛 KRAS 抑制劑(通過靶向調節 KRAS 活性的蛋白來實現調控 KRAS 活性) 正在臨床開發階段。勃林格殷格翰宣布了一種 SOS1(一種鳥嘌呤核苷酸交換因子) 抑制劑 BI-1701963 正處于臨床一期試驗階段,它可以破壞 SOS1 介導的 KRAS 的核苷酸交換。此外,鑒于 SHP2 在 KRAS 激活過程中發揮了不可或缺的作用,一些 SHP2 抑制劑(如 TNO155、 RMC-4630 和 JNJ-3068) 正在進行早期臨床試驗[10]。
表 1. FDA 批準的 KRAS G12C 抑制劑臨床試驗
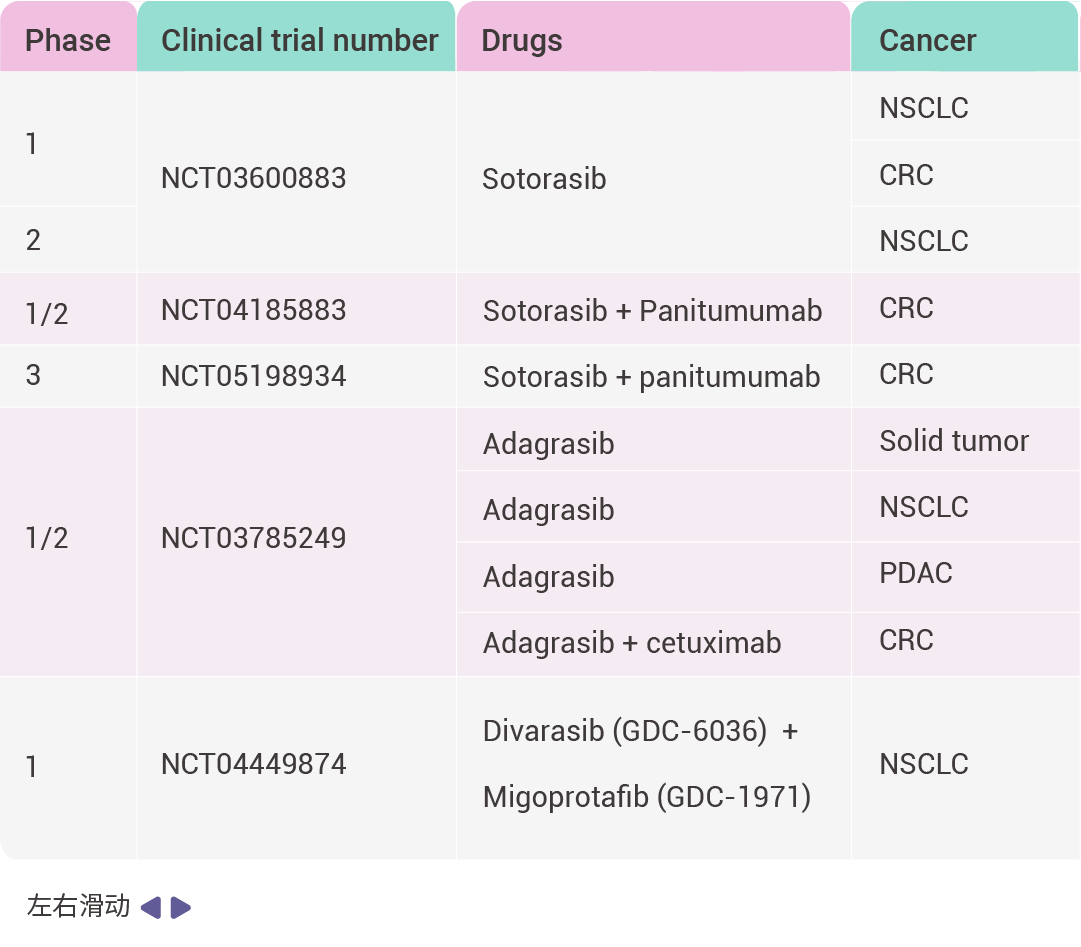
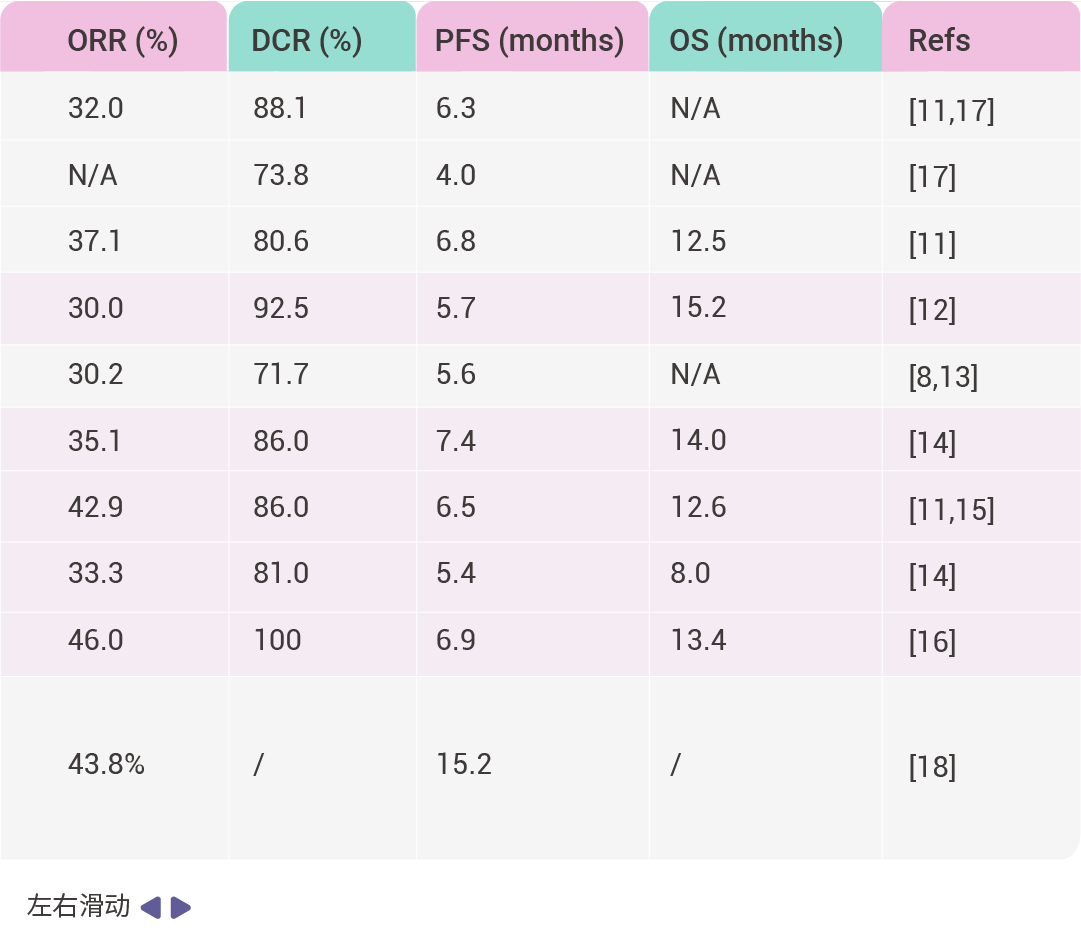
縮寫詞: objective response rate (ORR); progression-free survival (PFS); disease control rate (DCR); overall survival (OS).
Section.03
KRAS G12D 抑制劑
由于其他 KRAS 突變的高流行率,針對其他突變選擇性抑制劑以及泛 KRAS 抑制劑的開發也在進行中,一部分新型 KRAS 抑制劑正在進行臨床試驗。特別是 KRAS G12D 已成為開發新型抑制劑的方向,因為該突變占所有 KRAS 突變的約 28%,并且是胰腺導管腺癌和結直腸癌中最常見的突變 [5] 。目前,還沒有獲得 FDA 批準的針對 KRAS G12D 的特異性抑制劑, KRAS G12D 突變的癌癥代表著一個重要的未滿足的醫療需求。
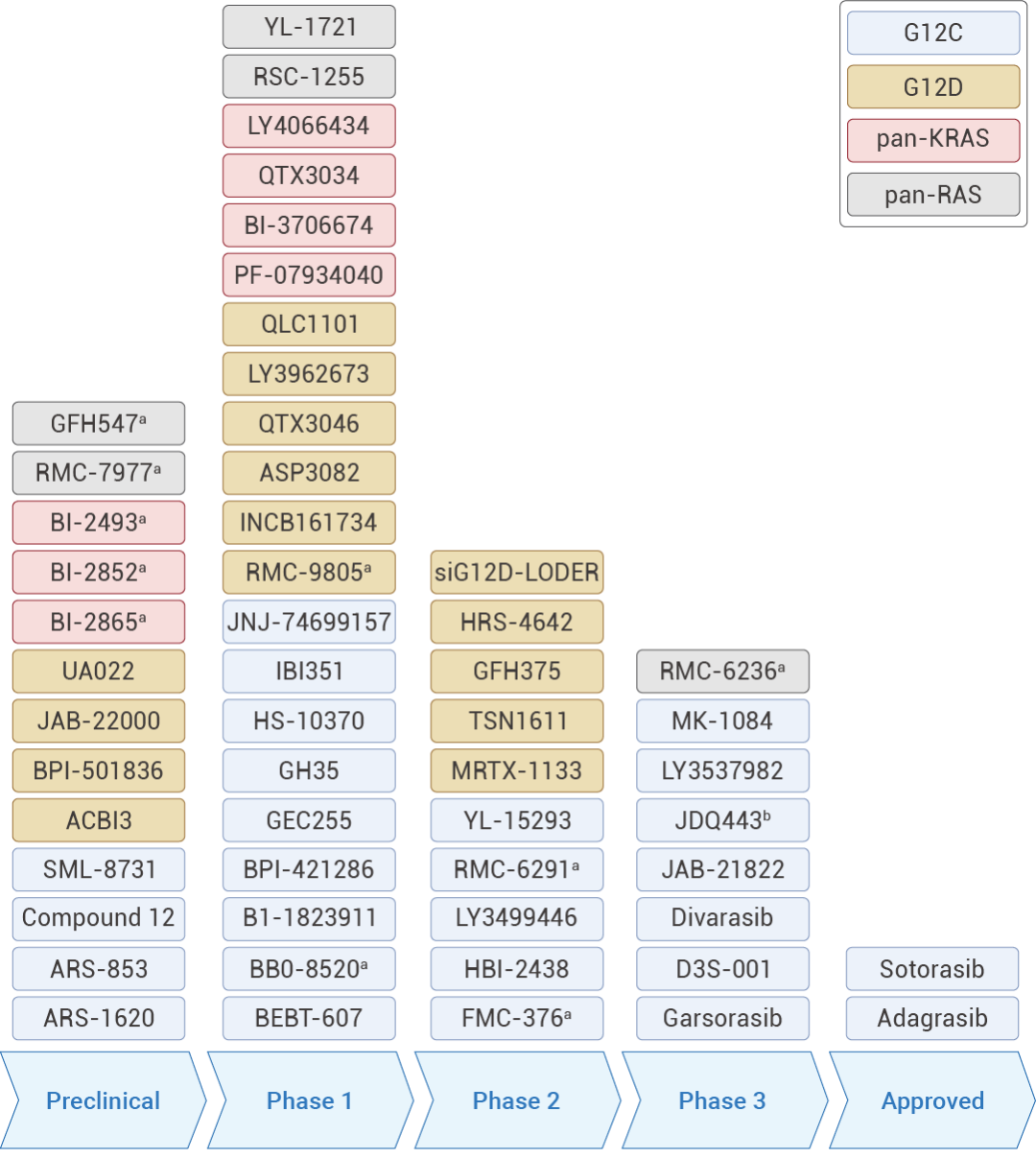 圖 3. 臨床在研的 RAS 抑制劑
[5]
。
圖 3. 臨床在研的 RAS 抑制劑
[5]
。
靶向 G12C 的抑制劑共價結合到 KRAS G12C 突變體中的半胱氨酸殘基,使蛋白質穩定在非活性的 GDP 結合狀態。遺憾的是,這一策略不適用于 KRAS G12D ,因為 KRAS G12D 突變體中的天冬氨酸殘基的羧基親核性弱于半胱氨酸的巰基 [2] 。這種差異導致了如 MRTX849 等化合物對 KRAS G12C 具有顯著作用,但對 KRAS G12D 沒有影響。
由于無法直接靶向,Mirati Therapeutics 公司基于 MRTX849 的結構將烯酰胺基團替換為哌嗪基團開發出了 MRTX1133 [2][3]。MRTX1133 的哌嗪基團與 KRAS G12D 的天冬氨酸殘基之間形成離子鍵從而實現非共價結合。MRTX1133 與 KRAS G12D 的非共價結合阻止了核苷酸交換和效應 RAF 的結合,抑制了 KRAS 下游通路激活所必需的蛋白質-蛋白質相互作用[2][3]。由于 MRTX-1133 的設計是基于 MRTX849 的結構,因此其他靶向 G12C 的藥物也可以經過修飾,使其對 G12D 突變的癌癥具有反應性。
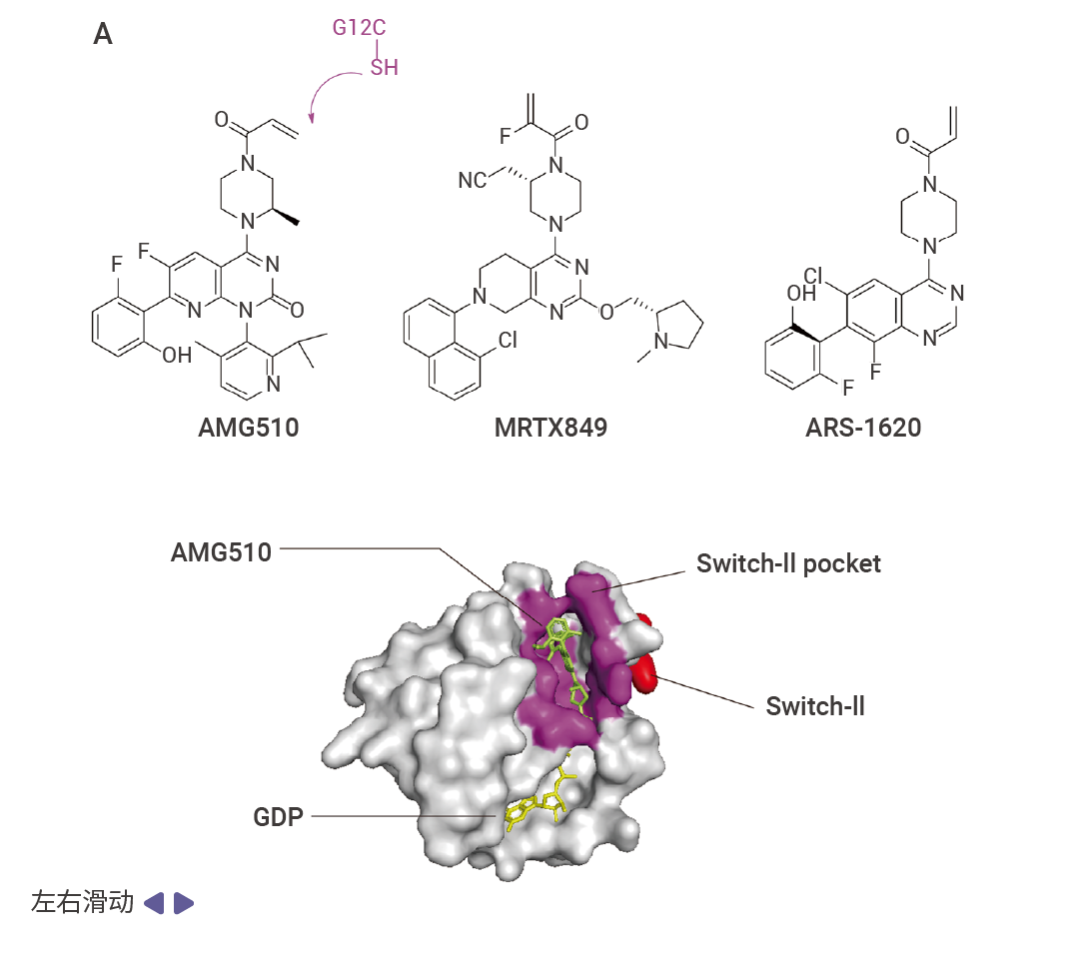
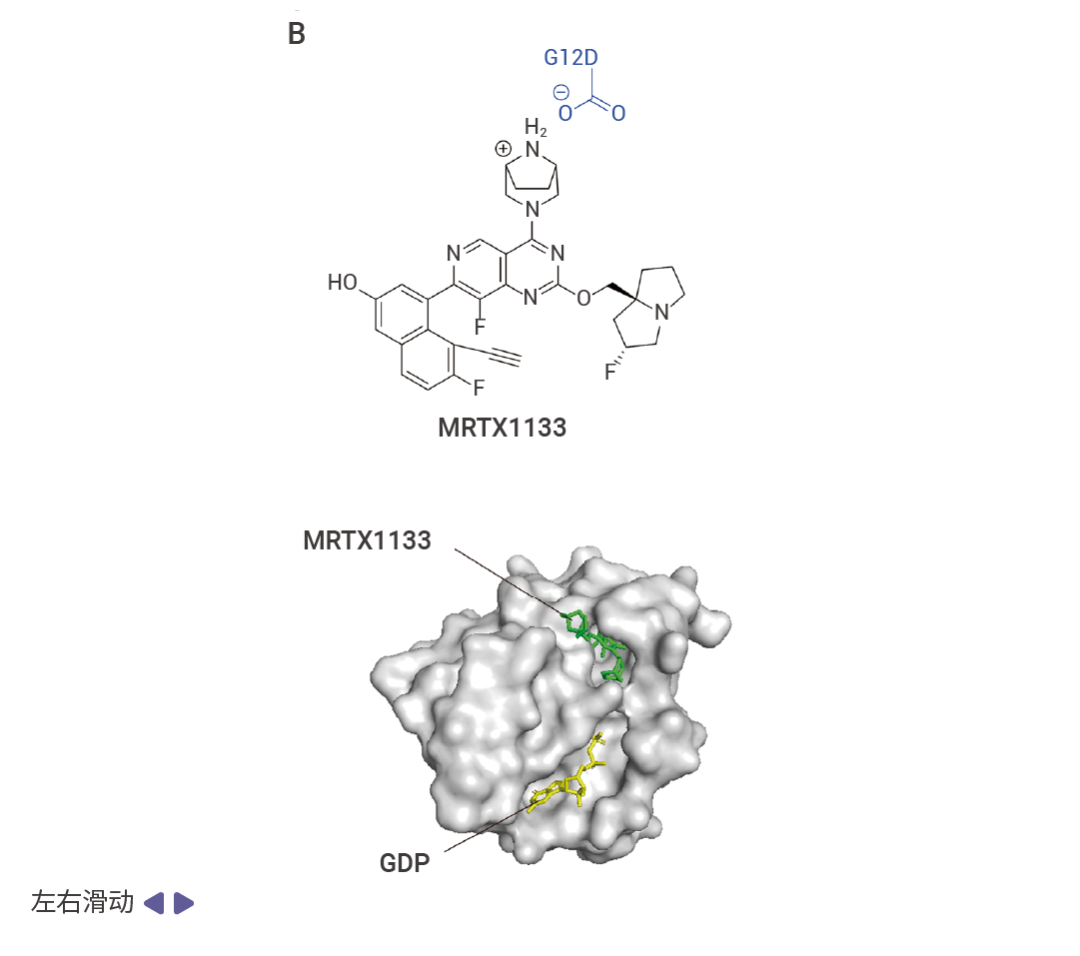
圖 4. KRAS 突變抑制劑與 KRAS 結合示意圖 [2] 。
A. AMG510 與 KRAS G12C 的 Switch-II 口袋(紫色)結合;B. MRTX1133 與 KRAS G12D 結合。
RMC-9805 的開發策略與 MRTX1133 不同。RMC-9805 首先在 KRAS G12D 與親環素 A 之間形成非共價鍵,從而形成 KRAS、親環素 A 和 RMC-9805 的三元復合物,導致 RMC-9805 與天冬氨酸緩慢地共價結合,阻斷 KRAS 效應蛋白的不可逆下游結合[3]。這種相互作用通過破壞 KRAS G12D 的下游信號效應分子 (如 RAF),選擇性且持續地修飾 KRAS G12D,從而誘導細胞凋亡并抑制細胞增殖。
在接受至少 14 周 RMC-9805 治療的 KRAS G12D 突變的胰腺導管腺癌患者中,客觀緩解率 (ORR) 為 30% (n=12) ,疾病控制率 (DCR) 為 80% ( n=32) [ 11] 。此外,RMC-9805 顯示出了出色的安全性特征,并且在不同劑量下總體耐受性良好。這些結果表明,RMC-9805 具有令人鼓舞的臨床表現。
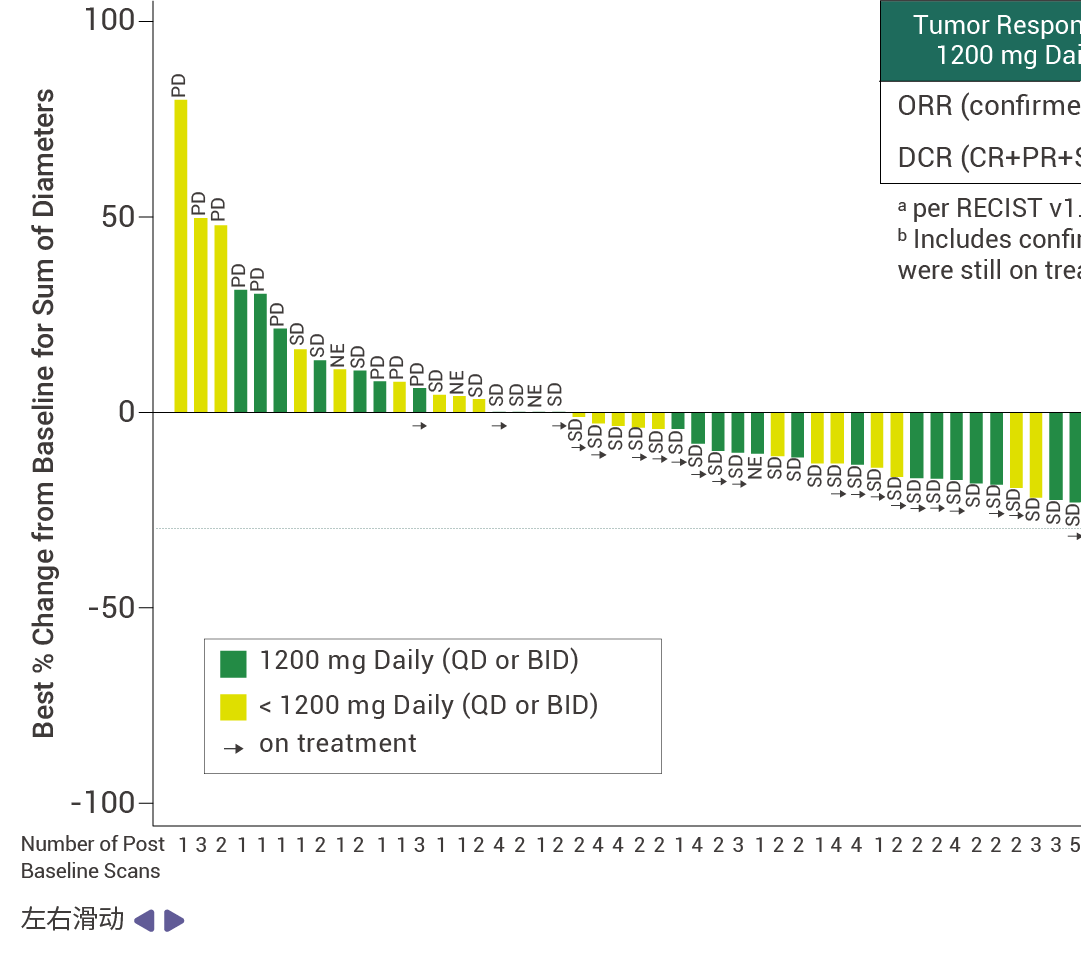
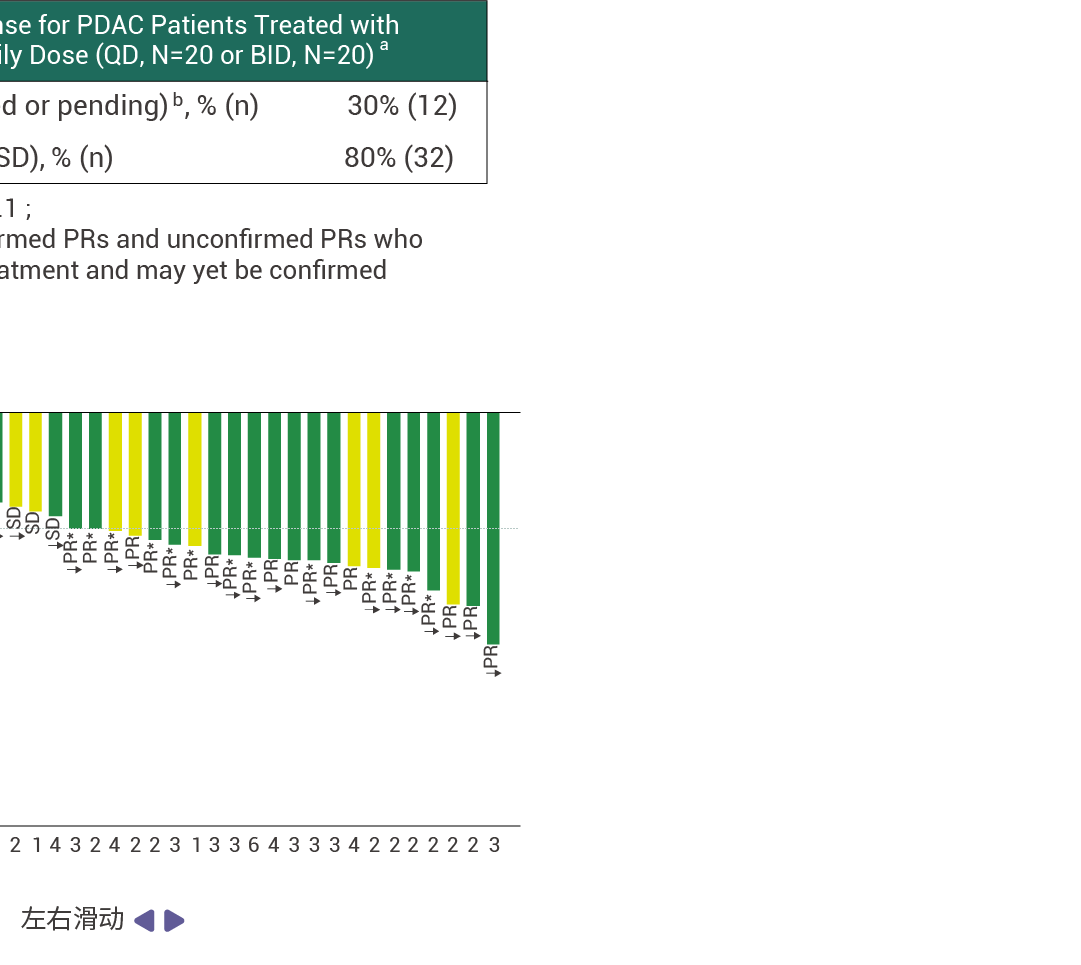
圖 5. RMC-9805 對胰腺導管腺癌患者具有抗腫瘤活性 [11] 。
MRTX1133 和 RMC-9805 只在 KRAS G12D (ON;GTP 結合) 處于活性狀態時與其結合。相比之下,VS-7375 (GFH375) 在活性狀態和非活性狀態 (OFF;GDP 結合) 下都能與 KRAS G12D 結合。因此,與僅在活性狀態或僅在非活性狀態下抑制 KRAS G12D 的化合物相比,VS-7375 更有可能更完全地抑制 KRAS G12D 信號傳導和腫瘤生長。VS-7375 在體內多種 KRAS G12D 腫瘤模型中作為單藥或與包括 cetuximab 在內的其他抗癌藥物聯合使用時都表現出良好的抗腫瘤活性 [12] 。這些結果支持對 VS-7375 用于治療 KRAS G12D 突變癌癥患者的臨床評估。
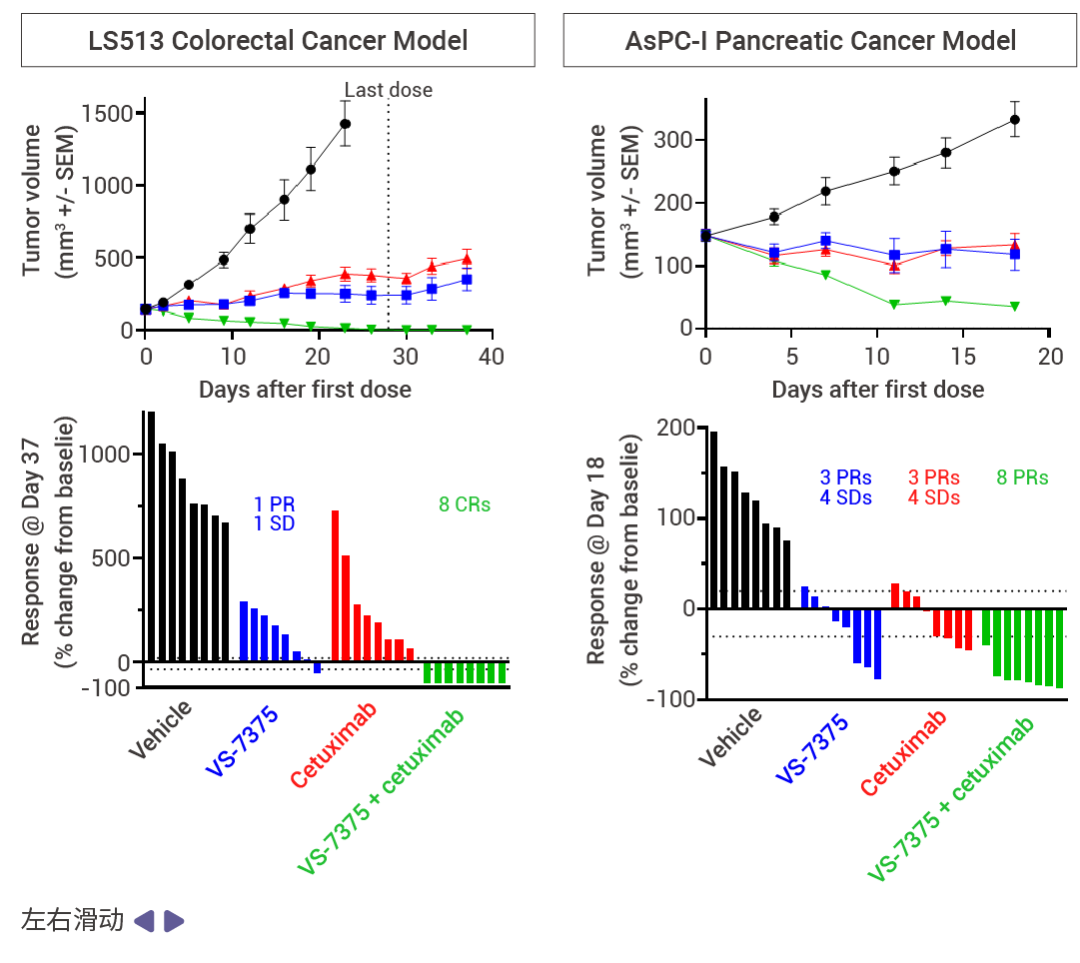
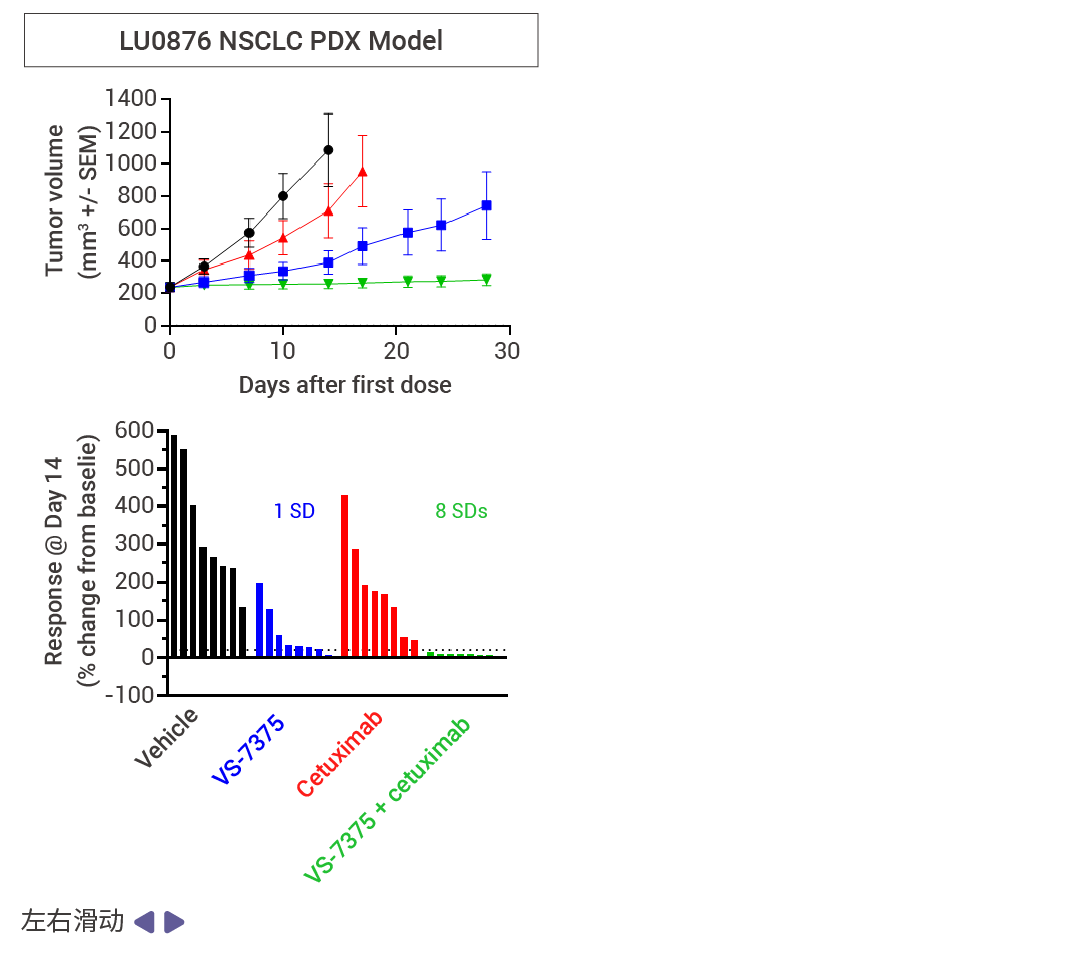
圖 7. 使用 VS-7375 或 cetuximab 治療接種了 LS513, AsPC-1 或 LU876 細胞(KRAS G12D 突變)的小鼠 [12] 。
其他 KRAS G12D 抑制劑包括 HRS-4642 、TH-Z835、JAB-22000 和 ERAS-4 等也正在開發。還有一種 KRAS G12D 降解劑 ASP3082 通過將 KRAS G12D 與 E3 泛素連接酶結合促進蛋白降解[3]。
Section.04
小結
特異性 KRAS G12C 抑制劑改變了 KRAS 突變癌癥的治療格局,使許多 KRAS 突變癌癥患者受益。不幸的是,對 KRAS 抑制劑的先天和獲得性耐藥阻礙了它們的發展,使這些新藥的療效降低甚至無效。作為常見的 KRAS 突變之一。KRAS G12D 驅動高度免疫抑制的腫瘤微環境,并表現出強大的致癌潛力。因此,開發 KRAS G12D 抑制劑以及其他泛 KRAS 抑制劑是 KRAS 靶向治療的新方向。
| 產品推薦 |
| Sotorasib (AMG-510) 是一種有效的,口服生物可利用的,選擇性的 KRAS G12C 共價抑制劑。Sotorasib 將 KRAS G12C 鎖定在非活躍的 GDP 約束狀態。Sotorasib 導致 KRAS G12C 突變的局部晚期或轉移性非小細胞肺癌 (NSCLC) 的消退。 |
| Adagrasib (MRTX849) 是一種有效,口服可用,突變選擇性的 KRAS G12C 共價抑制劑,具有潛在抗腫瘤活性的。Adagrasib 在半胱氨酸 12 殘基處與 KRAS G12C 共價結合,將蛋白鎖定在非活性的 GDP 結合構象中,并抑制 KRAS 依賴性信號轉導。 |
| Fulzerasib (GFH925) 是一種不可逆的 KRAS G12C 抑制劑,與西妥昔單抗 (HY-P9905) 具有協同抗癌作用。 |
| Opnurasib (JDQ-443) (NVP-JDQ443) 是一種口服有效和選擇性的共價 KRAS G12C 抑制劑。Opnurasib 具有抗腫瘤活性。 |
| Elisrasib 是口服有效的 KRAS 抑制劑。Elisrasib 抑制 KRAS G12C 突變體 H358 和 MIA-PA-CA-2 的增殖,IC50 分別為 0.6 和 0.44 nM。Elisrasib 在多物種的肝細胞、肝微粒體、血漿和全血中表現出良好的代謝穩定性。Elisrasib 在小鼠中表現出良好的藥代動力學特征和抗腫瘤活性。 |

[1] Huang, Lamei et al. Signal Transduct Target Ther. 2021 Nov 15;6(1):386.
[2] Zhu, Chunxiao et al. Mol Cancer. 2022 Aug 4;21(1):159.
[3] Zeissig, Mara N et al. Trends Cancer. 2023 Nov;9(11):955-967.
[4] O'Sullivan, éabha et al. Cancers (Basel). 2023 Mar 7;15(6):1635.
[5] Isermann, Tamara et al. Trends Cancer. 2025 Feb;11(2):91-116.
[6] Toribio, María Luisa, and Sara González-García. Int J Mol Sci. 2023 Jan 10;24(2):1383.
[7] Prahallad, Anirudh et al. Nature. 2012 Jan 26;483(7387):100-3.
[8] Fakih, Marwan G et al. N Engl J Med. 2023 Dec 7;389(23):2125-2139.
[9] Yaeger, Rona et al. Cancer Discov. 2024 Jun 3;14(6):982-993.
[10] Hofmann, Marco H et al. Cancer Discov. 2022 Apr 1;12(4):924-937.
[11] Pancreatic Cancer Update. Retrieved October 25, 2024.
[12] VS-7375 (GFH375): An oral, selective KRAS G12D (ON/OFF) inhibitor with potent anti-tumor efficacy as single agent and in combination with other anticancer therapies in preclinical models.


本站“ABIO生物試劑品牌網”圖片文字來自互聯網
如果有侵權請聯系微信: nanhu9181 處理,感謝~





