《Nature》子刊:支持實(shí)時(shí)掃描自動(dòng)修圖的光聲超聲雙模成像_abio生物試劑品牌網(wǎng)
陳武凡教授團(tuán)隊(duì)(南方醫(yī)科大學(xué)),其在2023年《Photoacoustics》期刊發(fā)表了光聲斷層圖像復(fù)原算法研究成果,提出基于深度學(xué)習(xí)的DIPP框架以提升成像質(zhì)量;王皓宇等人(西安電子科技大學(xué))于2024年在《Photoacoustics》提出極值引導(dǎo)插值算法,顯著優(yōu)化了稀疏光聲重建的分辨率;黃鵬教授團(tuán)隊(duì)(深圳大學(xué))則在2025年《Science Advances》中開發(fā)了可逆光開關(guān)蛋白組裝體DrBphP-CBD,大幅提高腫瘤光聲成像的對(duì)比度和靶向性。這些研究共同推動(dòng)光聲成像技術(shù)向精準(zhǔn)化、智能化方向邁進(jìn)。
重要發(fā)現(xiàn)
01多模態(tài)成像系統(tǒng)的構(gòu)建
研究團(tuán)隊(duì)設(shè)計(jì)了光聲-超聲融合成像系統(tǒng),整合1-kHz波長(zhǎng)可調(diào)諧激光(700–900nm)與Verasonics超聲掃描儀(Vantage系統(tǒng)),通過(guò)光纖陣列實(shí)現(xiàn)窄光束快速掃描。實(shí)驗(yàn)中,激光脈沖照射小鼠腫瘤組織,激發(fā)的光聲信號(hào)與超聲信號(hào)同步采集,構(gòu)建出三維光吸收分布與結(jié)構(gòu)圖像。例如,在黑色素瘤模型中,系統(tǒng)通過(guò)波長(zhǎng)復(fù)合成像(Σλ-PA)對(duì)多波長(zhǎng)光聲信號(hào)進(jìn)行相干求和,將信噪比提升至傳統(tǒng)方法的3倍以上,清晰顯示腫瘤新生血管的分布特征。
針對(duì)活體組織呼吸、心跳等生理運(yùn)動(dòng)導(dǎo)致的偽影問(wèn)題,團(tuán)隊(duì)引入超聲散斑跟蹤(US Speckle Tracking)技術(shù),通過(guò)分析超聲圖像中散斑的位移,實(shí)時(shí)校正光聲信號(hào)的空間位置,使成像誤差降低至±5μm。同時(shí),基于光纖掃描數(shù)據(jù),系統(tǒng)可動(dòng)態(tài)估計(jì)光fluence分布(即光在組織中的衰減程度),并通過(guò)算法補(bǔ)償不同波長(zhǎng)激光的穿透差異。在離體豬心臟實(shí)驗(yàn)中,該方法成功消除了因組織不均勻吸收導(dǎo)致的圖像失真,實(shí)現(xiàn)了冠狀動(dòng)脈的高精度三維重建。
03 分子特異性成像的實(shí)現(xiàn)
通過(guò)成分加權(quán)成像(Component-Weighted PA),團(tuán)隊(duì)利用光譜相關(guān)性分析,從復(fù)雜生物背景中特異性識(shí)別目標(biāo)分子。例如,在注射金納米棒(GNR)的小鼠模型中,系統(tǒng)通過(guò)對(duì)比780nm和820nm波長(zhǎng)下的光聲信號(hào),成功分離出GNR的光譜特征,其檢測(cè)靈敏度達(dá)到1nM,比傳統(tǒng)熒光成像高2個(gè)數(shù)量級(jí)。此外,深圳大學(xué)黃鵬團(tuán)隊(duì)開發(fā)的DrBphP-CBD蛋白組裝體,通過(guò)光開關(guān)機(jī)制進(jìn)一步提升了腫瘤靶向成像的對(duì)比度——在10mm深度的雞胸肉組織中,差分圖像信噪比提高了17.7倍,且瘤內(nèi)滯留時(shí)間長(zhǎng)達(dá)72小時(shí)。
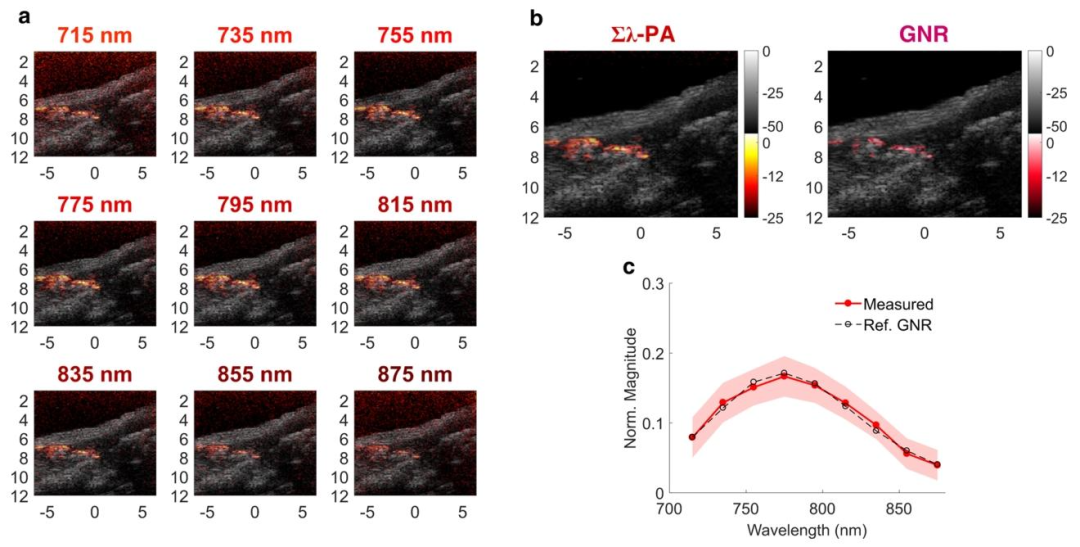
將GNR注射到小鼠右腿肌肉的體內(nèi)光譜成像案例(2)
創(chuàng)新與亮點(diǎn)
01動(dòng)態(tài)光聲-超聲融合機(jī)制
傳統(tǒng)光聲成像受限于寬光束照明導(dǎo)致的波長(zhǎng)依賴性衰減,而PAUS技術(shù)通過(guò)光纖窄光束掃描,將光fluence變化控制在5%以內(nèi),同時(shí)結(jié)合超聲散斑跟蹤實(shí)現(xiàn)亞微米級(jí)運(yùn)動(dòng)校正,首次在活體動(dòng)物中實(shí)現(xiàn)了無(wú)偽影、全波長(zhǎng)覆蓋的實(shí)時(shí)成像。這一突破為臨床動(dòng)態(tài)監(jiān)測(cè)(如藥物代謝、血流動(dòng)力學(xué))提供了可能。
系統(tǒng)兼具高分辨率與大成像深度:通過(guò)光聲顯微鏡(PAM)可觀察單細(xì)胞水平的結(jié)構(gòu)(如神經(jīng)元突觸),而光聲斷層掃描(PAT)可穿透數(shù)厘米組織,清晰顯示小鼠腦部深層血管網(wǎng)絡(luò)。例如,在乳腺癌模型中,PAUS系統(tǒng)不僅能識(shí)別腫瘤邊界的微血管,還能通過(guò)光譜分析評(píng)估腫瘤缺氧程度,為個(gè)性化治療方案提供依據(jù)。
03 智能算法的深度賦能
團(tuán)隊(duì)將深度學(xué)習(xí)與光聲成像結(jié)合,開發(fā)了DIPP框架用于圖像復(fù)原,通過(guò)學(xué)習(xí)空變退化模型,使光聲斷層圖像的分辨率提升30%以上。此外,極值引導(dǎo)插值算法顯著減少了稀疏采樣下的重建誤差,在保持成像速度的同時(shí),將血管邊緣清晰度提高40%。這些算法為未來(lái)便攜式光聲設(shè)備的開發(fā)奠定了基礎(chǔ)。
總結(jié)與展望
光聲超聲融合技術(shù)的誕生,標(biāo)志著生物醫(yī)學(xué)成像從“結(jié)構(gòu)觀察”向“功能解析”的跨越。其通過(guò)多模態(tài)數(shù)據(jù)融合、動(dòng)態(tài)誤差校正和分子特異性識(shí)別,成功解決了傳統(tǒng)光聲成像在臨床轉(zhuǎn)化中的核心挑戰(zhàn),為腫瘤早篩、神經(jīng)科學(xué)研究和藥物研發(fā)提供了前所未有的工具。目前,該技術(shù)已在小動(dòng)物模型中實(shí)現(xiàn)了血管、腫瘤和器官的高精度成像,并初步展示了在心血管疾病和腦功能研究中的應(yīng)用潛力。
未來(lái),隨著光纖技術(shù)、納米材料和人工智能的深度融合,光聲成像有望進(jìn)一步突破現(xiàn)有局限:例如,開發(fā)可穿戴式光聲探頭以實(shí)現(xiàn)連續(xù)健康監(jiān)測(cè),或結(jié)合近紅外二區(qū)成像技術(shù)(1000–1700nm)提升深層組織穿透能力。此外,通過(guò)設(shè)計(jì)靶向性更強(qiáng)的光聲對(duì)比劑(如pH響應(yīng)型納米顆粒),可實(shí)現(xiàn)疾病標(biāo)志物的超靈敏檢測(cè),推動(dòng)精準(zhǔn)醫(yī)學(xué)的發(fā)展。可以預(yù)見,光聲成像技術(shù)將在活體分子成像、術(shù)中導(dǎo)航和個(gè)性化治療等領(lǐng)域發(fā)揮關(guān)鍵作用,成為連接基礎(chǔ)研究與臨床應(yīng)用的重要橋梁。
論文信息聲明:本文僅用作學(xué)術(shù)目的。
Jeng GS, Li ML, Kim M, Yoon SJ, PItre JJ Jr, Li DS, Pelivanov I, O'Donnell M. Real-time interleaved spectroscopic photoacoustic and ultrasound (PAUS) scanning with simultaneous fluence compensation and motion correction. Nat Commun. 2021 Jan 29;12(1):716.
DOI:10.1038/s41467-021-20947-5.
本站“ABIO生物試劑品牌網(wǎng)”圖片文字來(lái)自互聯(lián)網(wǎng)
如果有侵權(quán)請(qǐng)聯(lián)系微信: nanhu9181 處理,感謝~